题目内容
16.关于物质的检验,下列判断正确的是( )| A. | 在溶液中加入盐酸酸化,无现象;再加入BaCl2溶液,如果生成白色沉淀,则原溶液中一定有大量的SO42-存在 | |
| B. | 在溶液中加入AgNO3溶液,生成不溶于硝酸的沉淀,则原溶液中一定有Cl-存在 | |
| C. | 在溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液 | |
| D. | 在溶液中加入KSCN溶液,无现象;再加入稀硝酸,溶液变血红色,则原溶液中一定有Fe2+存在 |
分析 A.加入盐酸,可排除亚硫酸根离子和银离子的干扰;
B.可能含有溴离子等;
C.可能为氨水;
D.亚铁离子可被硝酸氧化生成铁离子.
解答 解:A.盐酸排除其它离子的干扰,再加入BaCl2溶液,如果生成白色沉淀,沉淀为硫酸钡,则原溶液中一定有SO42-,故A正确;
B.如沉淀颜色不是白色,如为浅黄色,可能含有溴离子,故B错误;
C.如为氨水,则加入氢氧化钠溶液,也可能生成氨气,故C错误;
D.亚铁离子可被硝酸氧化生成铁离子,加入KSCN可变为红色,可用于检验,故D正确.
故选AD.
点评 本题考查物质的检验及鉴别,侧重离子的检验和气体的检验,注意实验中排除干扰及现象与结论的关系,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.已知甲、乙、丙、X是中学化学中四种常见的物质,其转化关系如图所示.则甲和X不可能是( )
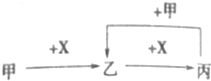
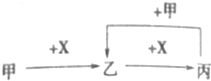
| A. | 甲为CO2,X为NaOH溶液 | B. | 甲为NH3,X为O2 | ||
| C. | 甲为Si,X为O2 | D. | 甲为NaAlO2,X为HCl溶液 |
4.钢铁在海水中的腐蚀过程如图所示,有关说法正确的是( )
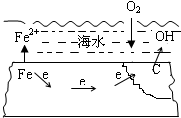

| A. | 该腐蚀过程为析氢腐蚀 | |
| B. | 正极的反应为:O2+2H2O+4e→4OH- | |
| C. | 碳上发生的是氧化反应 | |
| D. | 若该钢铁上焊有铜钉,其被腐蚀的速率将减小 |
11.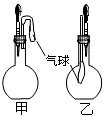 甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
 甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )
甲、乙两个装置中(如图),胶头滴管分别吸有某液体,平底烧瓶中置有其他物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).所用试剂分别是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:NaOH溶液和CO2 | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气 |
1.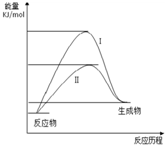 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
8.下列有关化学用语正确的是( )
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | F原子结构示意图: | |
| D. | MgCl2的电子式: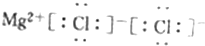 |
5.下列说法正确的是( )
| A. | 配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小 | |
| B. | pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿 | |
| C. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| D. | 石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏 |
19.下列物质有固定元素组成的是( )
| A. | 空气 | B. | 干冰 | C. | 氨水 | D. | 氯酸钾 |