题目内容
19.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
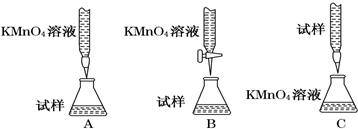
(2)某同学设计的下列滴定方式中,最合理的是B(夹持部分略去)(填字母序号)
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需250mL容量瓶、玻璃棒(填仪器名称).
在溶液配制过程中,下列操作会导致配制结果偏低的是cd(填写代号).
a.定容时,俯视容量瓶刻度线
b.容量瓶在使用前内有少量蒸馏水
c.转移溶液后的烧杯、玻璃棒未洗涤
d.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是b.
a.浓盐酸 b.稀硫酸 c.稀硝酸 d.浓硫酸
方案二 称量法:操作流程如下:
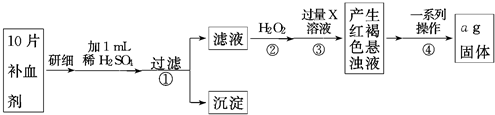
(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式2Fe2++H2O2+2 H+=2Fe3++2 H2O.
步骤②中除用H2O2外还可以使用的物质是氯水
步骤②是否可以省略否,理由是Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量.
(6)步骤④一系列操作依次是:过滤、洗涤、灼烧、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量0.07ag(用含a的代数式表示).
分析 方案一:(1)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水;
(2)酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(4)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸;
方案二:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(5)步骤②加入H2O2将Fe2+全部氧化为Fe3+,本身被还原成水,据此书写离子方程式;
步骤②加入有强氧化性试剂,能将Fe2+全部氧化为Fe3+就好;
Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(7)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:方案一:(1)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(2)酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,故B最合适;
故答案为:B;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、250mL容量瓶;
a.定容时,俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高;
b.容量瓶在使用前内有少量蒸馏水,对溶液体积和溶质的物质的量都不产生影响,溶液浓度不变;
c.转移溶液后的烧杯、玻璃棒未洗涤,导致溶质部分损耗,溶质是物质的量偏小,溶液浓度偏低;
d.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,导致溶液体积偏大,则溶液浓度偏低;
则偏低的为cd;故答案为:250mL容量瓶、玻璃棒;cd;
(4)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原性要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸,故答案为:b;
方案二:
(5)步骤②加入H2O2将Fe2+全部氧化为Fe3+,本身被还原成水,离子方程式为2Fe2++H2O2+2 H+=2Fe3++2 H2O;
步骤②加入有强氧化性试剂,能将Fe2+全部氧化为Fe3+,除用H2O2外还可以使用氯水等;
Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:2Fe2++H2O2+2 H+=2Fe3++2 H2O;氯水;否;Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
故答案为:灼烧;
(7)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10g}$=0.07ag;
故答案为:0.07a.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌).
比较两次实验的结果,其中正确的是( )
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
| 阳离子 | K+ Na+ Cu2+Al3+ |
| 阴离子 | SO42-HCO3-NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+.
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
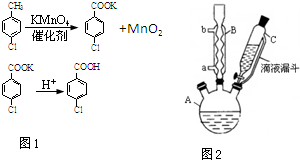 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:常温条件下的有关数据如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
请回答下列问题:
(1)装置B的名称是球形冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
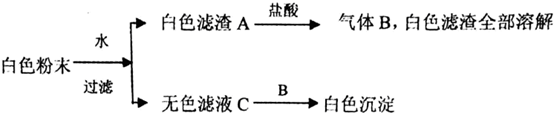
| A. | BaCl2,CaCO3一定存在,NaOH可能存在 | |
| B. | K2SO4、CuSO4一定不存在 | |
| C. | K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在 | |
| D. | C为单一溶质溶液 |
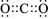 .
.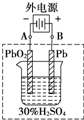 铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原): 一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.