题目内容
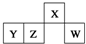 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:rW>rZ>rY>rX |
| B、含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z、W,W原子的最外层电子数是最内层电子数的3倍,若为2个电子层,则W的最外层电子数为6,所以W为O,由位置可知,不符合题意;若为3个电子层,则W的最外层电子数为6,所以W为S,由位置可知,X为N,Y为Al,Z为Si,结合元素及其单质、化合物的性质来解答.
解答:
解:短周期元素X、Y、Z、W,W原子的最外层电子数是最内层电子数的3倍,若为2个电子层,则W的最外层电子数为6,所以W为O,由位置可知,不符合题意;若为3个电子层,则W的最外层电子数为6,所以W为S,由位置可知,X为N,Y为Al,Z为Si,
A.电子层越多,半径越大,具有相同电子层的原子序数越大其原子半径越小,则原子半径为rY>rZ>rW>rX,故A错误;
B.Y为Al,它的硫酸盐溶液可以和强碱反应,不能和强酸反应,故B错误;
C.非金属性W>Z,则最简单气态氢化物的热稳定性为W>Z,故C错误;
D.X为N,X与氢元素组成的化合物XH5与水反应可产生氨气、氢气两种气体,故D正确;
故选D.
A.电子层越多,半径越大,具有相同电子层的原子序数越大其原子半径越小,则原子半径为rY>rZ>rW>rX,故A错误;
B.Y为Al,它的硫酸盐溶液可以和强碱反应,不能和强酸反应,故B错误;
C.非金属性W>Z,则最简单气态氢化物的热稳定性为W>Z,故C错误;
D.X为N,X与氢元素组成的化合物XH5与水反应可产生氨气、氢气两种气体,故D正确;
故选D.
点评:本题考查元素周期表和元素周期律,W为推断的突破口,明确元素在周期表中的位置及性质变化规律即可解答,题目难度中等.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列离子方程式正确的是( )
| A、铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑ |
| B、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
下列离子方程式中,不正确的是( )
| A、向FeCl2溶液中通入Cl22Fe2++Cl2=2Fe3++2Clˉ |
| B、FeCl3溶液跟过量氨水 Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+ |
| C、碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| D、钠与水的反应 2Na+2H2O=2Na++2OH-+H2↑ |
下列物质的水溶液在蒸发皿中加热蒸干灼烧,能得到原物质的是( )
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
| A、①③⑤⑥⑧⑩ | B、②③④⑤⑨⑩ |
| C、③⑤⑦⑩ | D、①③⑩ |
“化学是实验的科学,只有实验才是检验理论的标准”.下列关于各实验装置图的叙述中,正确的是( )

| A、装置①是用于分离互不相溶的液体混合物 |
| B、装置②可用于吸收NH3并防止倒吸 |
| C、以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D、装置④中b进气可收集Cl2、NO等气体 |
查处酒后驾驶所采用的“便携式乙醇测量仪”以燃料电池为工作原理;在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际上乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+.下列说法正确的是( )
| A、另一电极反应式为:O2+4e-+2H2O=4OH- |
| B、检测时,溶液中的H+向负极移动 |
| C、乙醇在正极发生反应,电子经过外电路流向负极 |
| D、电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |