题目内容
查处酒后驾驶所采用的“便携式乙醇测量仪”以燃料电池为工作原理;在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际上乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+.下列说法正确的是( )
| A、另一电极反应式为:O2+4e-+2H2O=4OH- |
| B、检测时,溶液中的H+向负极移动 |
| C、乙醇在正极发生反应,电子经过外电路流向负极 |
| D、电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:酸性环境下,乙醇被氧化,则为负极反应,正极上氧气得电子和氢氧根离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,电池总反应与乙醇燃烧的方程式相同,应为2CH3CH2OH+O2→2CH3CHO+2H2O,原电池放电时,阳离子向正极移动,电子从负极沿导线流向正极.
解答:
解:A、电解质溶液呈酸性,正极反应式为O2+4e-+4H+=2H2O,故A错误;
B、放电时,电解质溶液中氢离子向正极移动,故B错误;
C、乙醇在负极上失电子发生氧化反应,氧气在正极上得电子发生还原反应,电子从负极沿导线流向正极,故C错误;
D、电池总反应与乙醇燃烧的方程式相同,应为2CH3CH2OH+O2→2CH3CHO+2H2O,故D正确;
故选D.
B、放电时,电解质溶液中氢离子向正极移动,故B错误;
C、乙醇在负极上失电子发生氧化反应,氧气在正极上得电子发生还原反应,电子从负极沿导线流向正极,故C错误;
D、电池总反应与乙醇燃烧的方程式相同,应为2CH3CH2OH+O2→2CH3CHO+2H2O,故D正确;
故选D.
点评:本题考查了原电池原理,根据正负极上发生的电极反应及电子、电解质溶液中阴阳离子移动方向来分析解答即可,易错选项是A,写电极反应式时要注意结合溶液的酸碱性,在酸性溶液,生成物中不能有氢氧根离子生成,在碱性溶液中,生成物中不能有氢离子生成.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
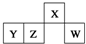 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:rW>rZ>rY>rX |
| B、含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
下列提纯方法不正确的是( )
| A、除去KNO3中的NaCl杂质---结晶. |
| B、除去食盐中的泥沙-----过滤 |
| C、除去KCl中的K2CO3-----加适量盐酸 |
| D、除去碘水中的水-----升华 |
在KClO3+5KCl+3H2SO4═3K2SO4+3Cl2↑+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )
| A、1:1 | B、5:1 |
| C、1:5 | D、3:1 |
已知甲醇的燃烧热数值为726.51kJ?mol-1.下列热化学方程式书写正确的是( )
A、CH4O+
| ||
B、CH4O(l)+
| ||
| C、2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ?mol-1 | ||
D、CH4O(l)+
|
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关说法正确的是( )
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂与氧化剂的物质的量之比为1:2 |
| C、若生成0.2molHNO3,转移0.2 mol电子 |
| D、NF3在潮湿空气中泄漏会产生红棕色气体 |
下列说法中正确的是( )
| A、光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 |
| B、开发核能、太阳能等新能源,推广基础甲醇汽油、使用无磷洗涤剂都可直接降低碳排放 |
| C、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| D、通电时,溶液中的溶质离子分别向两极移动,胶体中的分散质粒子向某一极移动 |