题目内容
14.下列关于化学键的说法中,正确的是( )| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 金属元素与非金属元素间一定形成离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
分析 A.含离子键的化合物一定为离子化合物,不一定含金属元素;
B.氯化铝中氯原子和铝原子间存在共价键;
C.稀气体单质分子中不存在任何化学键;
D.氯化铵是由非金属元素形成的离子化合物.
解答 解:A.含离子键的化合物一定为离子化合物,不一定含金属元素,如铵盐,故A错误;
B.金属元素与非金属元素化合时一定形成离子键,如氯化铝中氯原子和铝原子间存在共价键,故B错误;
C.稀气体单质分子中不存在任何化学键,所以构成单质分子的微粒不一定含有共价键,故C错误;
D.由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如氯化铵是离子化合物,但它是由非金属元素组成,故D正确;
故选D.
点评 本题考查了化学键和化合物的关系,易错选项是C,注意:不是所有物质都含有化学键,稀有气体中不含化学键,只存在分子间作用力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用托盘天平称取3.2gNaCl固体 | |
| B. | 用10mL量筒量取7.50mL稀盐酸 | |
| C. | 用450mL的容量瓶配制450mL溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
2.按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是( )
| A. | Fe | B. | Na | C. | P | D. | La |
19.下列有关物质性质的应用不正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属 | |
| C. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| D. | 小苏打受热易分解,常用于做面包发酵粉 |
6.下列溶液能用来区分SO2和CO2气体的是( )
| A. | 澄清石灰水 | B. | 双氧水 | C. | 酸性高锰酸钾 | D. | 氯化钡溶液 |
3.Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质.一种制备Na2FeO4的方法为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是( )
| A. | 在反应中氧化剂是Na2O2,还原剂是FeSO4 | |
| B. | 生成2molNa2FeO4时,反应中共有8mol电子转移 | |
| C. | 反应中生成22.4LO2时,共有10mol电子转移 | |
| D. | Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
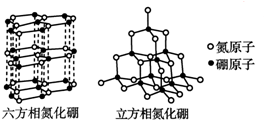 新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.
新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.