题目内容
10.下列各项中电解质的电离方程式中正确的是( )| A. | NaHCO3 的水溶液:NaHCO3═Na++H++CO32- | |
| B. | 熔融状态的NaHSO4:NaHSO4═Na++HSO4- | |
| C. | HF的水溶液:HF═H++F- | |
| D. | H2S 的水溶液:H2S?2H++S2- |
分析 A.碳酸氢根离子为弱酸的酸式根离子,不能拆;
B.硫酸氢钠在熔化状态下电离产生钠离子和硫酸氢根离子;
C.氢氟酸为弱电解质,部分电离,用可逆号;
D.硫化氢为多元弱酸,分步电离,以第一步为主.
解答 解:A.NaHCO3 的水溶液,电离方程式:NaHCO3═Na++HCO3-,故A错误;
B.熔融状态的NaHSO4,电离方程式:NaHSO4═Na++HSO4-,故B正确;
C.氢氟酸为弱电解质,部分电离,电离方程式:HF?H++F-,故C错误;
D.H2S 的水溶液,电离方程式:H2S?H++HS-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20. (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
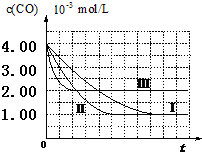
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D.
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D.
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
1. 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阳极:4OH --4e -═2H2O+O2↑ ②中负极:2H ++2e -═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
2.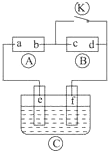 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )
 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e═-H2↑ | ||
| C. | f电极为锌板 | D. | e极发生还原反应 |
 .
.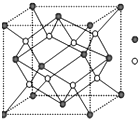 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)

