题目内容
某学生用浓度为0.1mol/L左右的KOH溶液滴定未知浓度的盐酸,有如下操作步骤:
(A)移取20.00mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用KOH溶液润洗滴定管2-3次
(C)把盛有KOH溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至O或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用KOH溶液滴定至终点,记下滴定管液面的刻度
回答下列问题:
(1)正确操作的顺序是 (填编号)
(2)实验室可提供下列浓度的KOH浓液,应选用的是 .(填编号)
A.0.1mol/L B.O.10m01/L C.O.1032mol/L
(3)(A)操作中量取待测液的仪器是 .
(4)(B)操作的目的是 .
(5)(F)操作中判断到达终点的现象是 .
(6)(B)如被省略所测结果 (填“偏大”、“偏小”、“不变”).
(7)KOH溶液在空气中易变质生成 ,该物质水溶液PH 7,其水溶液中离子浓度大小排序为
(8)(C)步如何使滴定管尖嘴充满溶液 .
(A)移取20.00mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用KOH溶液润洗滴定管2-3次
(C)把盛有KOH溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至O或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用KOH溶液滴定至终点,记下滴定管液面的刻度
回答下列问题:
(1)正确操作的顺序是
(2)实验室可提供下列浓度的KOH浓液,应选用的是
A.0.1mol/L B.O.10m01/L C.O.1032mol/L
(3)(A)操作中量取待测液的仪器是
(4)(B)操作的目的是
(5)(F)操作中判断到达终点的现象是
(6)(B)如被省略所测结果
(7)KOH溶液在空气中易变质生成
(8)(C)步如何使滴定管尖嘴充满溶液
考点:中和滴定
专题:实验题
分析:(1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;
(2)根据部分氢氧化钾溶液与空气中的二氧化碳反应判断;
(3)根据滴定管的构造及选用方法解答;
(4)直接装入标准溶液,标准液的浓度偏低;
(5)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(6)根据c(酸)=
判断不当操作对相关物理量的影响;
(7)氢氧化钾溶液溶液与二氧化碳反应生成碳酸钾,根据碳酸钾溶液的性质进行判断;
(8)根据碱式滴定管中排气泡的方法解答.
(2)根据部分氢氧化钾溶液与空气中的二氧化碳反应判断;
(3)根据滴定管的构造及选用方法解答;
(4)直接装入标准溶液,标准液的浓度偏低;
(5)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(6)根据c(酸)=
| c(碱)×V(碱) |
| V(酸) |
(7)氢氧化钾溶液溶液与二氧化碳反应生成碳酸钾,根据碳酸钾溶液的性质进行判断;
(8)根据碱式滴定管中排气泡的方法解答.
解答:
解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为:A B D C E F或B D C E A F,
故答案为:A B D C E F或B D C E A F;
(2)氢氧化钾溶液溶液中部分氢氧化钾容易与空气中的二氧化碳反应,所以氢氧化钾的浓度稍大于0.1mol/L,所以C正确,
故答案为:C;
(3)实验室中量取20.00mL待测液盐酸,需要选用25mL的酸式滴定管,
故答案为:25mL酸式滴定管;
(4)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,
故答案为:避免滴管上残留的水稀释KOH溶液,造成误差;
(5)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:当溶液由无色变为浅红色,且在半分钟内不褪色;
(6)氢氧化钾为标准液,如果盛放标准液的滴定管没有润洗,会导致滴定消耗的标准液体积偏大,测定结果偏大,
故答案为:偏大;
(7)KOH溶液在空气中易变质生成碳酸钾,碳酸钾溶液中碳酸根离子部分水解,溶液显示碱性,溶液的pH>7;碳酸钾溶液中离子浓度大小关系为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:碳酸钾;>;c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(8)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,然后轻轻挤压玻璃球使尖嘴部分充满碱液,
故答案为:把滴定管的胶头部分稍微向上弯曲,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
故答案为:A B D C E F或B D C E A F;
(2)氢氧化钾溶液溶液中部分氢氧化钾容易与空气中的二氧化碳反应,所以氢氧化钾的浓度稍大于0.1mol/L,所以C正确,
故答案为:C;
(3)实验室中量取20.00mL待测液盐酸,需要选用25mL的酸式滴定管,
故答案为:25mL酸式滴定管;
(4)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,
故答案为:避免滴管上残留的水稀释KOH溶液,造成误差;
(5)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:当溶液由无色变为浅红色,且在半分钟内不褪色;
(6)氢氧化钾为标准液,如果盛放标准液的滴定管没有润洗,会导致滴定消耗的标准液体积偏大,测定结果偏大,
故答案为:偏大;
(7)KOH溶液在空气中易变质生成碳酸钾,碳酸钾溶液中碳酸根离子部分水解,溶液显示碱性,溶液的pH>7;碳酸钾溶液中离子浓度大小关系为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:碳酸钾;>;c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(8)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,然后轻轻挤压玻璃球使尖嘴部分充满碱液,
故答案为:把滴定管的胶头部分稍微向上弯曲,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
点评:本题考查酸碱中和滴定、盐的水解原理等知识,题目难度中等,试题涉及的题量较大,注意掌握中和滴定的操作方法,明确中和滴定实验的仪器、步骤、滴定终点的判断方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对于苯的说法下列叙述错误的是( )
| A、苯分子中的12个原子共面 |
| B、苯分子中没有C=C,存在一种介于C-C和C=C之间的独特的共价键 |
| C、苯分子中不仅六个碳原子等价,而且六个氢原子也完全等价 |
| D、苯不能使溴水褪色,但能够使酸性高锰酸钾溶液褪色 |
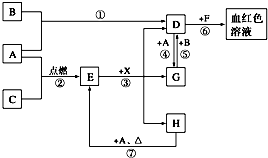 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).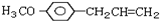 )医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效.根据题意完成下列填空:
)医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效.根据题意完成下列填空: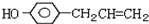 )与甲醇合成升白宁,该反应属于
)与甲醇合成升白宁,该反应属于
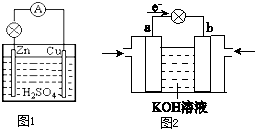 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.