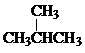题目内容
物质的量是高中化学中常用的物理量,请完成以下内容.
(1)0.05mol Na2SO4中含有 个氧原子
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为 .
(3)200mLAl2(SO4)3溶液中含Al3+5.4g,则溶液中c(SO42-)= .
(4)已知24gA和40gB恰好完全反应生成0.4molC和32gD,则C的摩尔质量为 .
(5)标准状况下,密度为1.25g/L的O2与CH4组成的混合气体中,O2的体积分数为 .
(1)0.05mol Na2SO4中含有
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为
(3)200mLAl2(SO4)3溶液中含Al3+5.4g,则溶液中c(SO42-)=
(4)已知24gA和40gB恰好完全反应生成0.4molC和32gD,则C的摩尔质量为
(5)标准状况下,密度为1.25g/L的O2与CH4组成的混合气体中,O2的体积分数为
考点:物质分子中的原子个数计算,摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)0.05mol硫酸钠中含有0.2mol氧原子,根据N=nNA计算出含有的氧原子数目;
(2)先根据一氧化碳和 二氧化碳的分子组成计算出二者的物质的量之比,相同条件下物质的量之比与体积之比成正比;
(3)先根据n=
计算出铝离子的物质的量,再根据硫酸铝的化学式组成计算出硫酸根离子的物质的量,最后根据c=
计算出硫酸根离子的浓度;
(4)根据质量守恒计算出C的质量,然后根据M=
计算出C的摩尔质量;
(5)根据M=ρ×22.4计算出混合气体的平均摩尔质量,再计算出二者的体积比及氧气的质量分数.
(2)先根据一氧化碳和 二氧化碳的分子组成计算出二者的物质的量之比,相同条件下物质的量之比与体积之比成正比;
(3)先根据n=
| m |
| M |
| n |
| V |
(4)根据质量守恒计算出C的质量,然后根据M=
| m |
| n |
(5)根据M=ρ×22.4计算出混合气体的平均摩尔质量,再计算出二者的体积比及氧气的质量分数.
解答:
解:(1)0.05mol Na2SO4中含有氧原子的物质的量为:0.05mol×4=0.2mol,含有的氧原子的数目为:N(O)=0.2×NA=0.2NA,
故答案为:0.2NA;
(2)标准状况下,含有相同氧原子数的CO与CO2的物质的量之比为:2:1,体积之比为:2:1,
故答案为:2:1;
(3)5.4g铝离子的物质的量为:
=0.2mol,根据Al2(SO4)3可知,溶液中含有的硫酸根离子的物质的量为:n(SO42-)=
×0.2mol=0.3mol,溶液中硫酸根离子的浓度为:c(SO42-)=
=1.5mol/L,
故答案为:1.5mol/L;
(4)已知24gA和40gB恰好完全反应生成0.4molC和32gD,根据质量守恒定律可知,0.4molC的质量为:40g+24g-32g=32g,则C的摩尔质量为:
=80g/mol,
故答案为:80g/mol;
(5)标准状况下,密度为1.25g/L的O2与CH4组成的混合气体中,混合气体的平均摩尔质量为:M=1.25g/L×22.4L/mol=28,设氧气的物质的量为x,甲烷的物质的量为y,则:
=28,解得:x:y=3:1,所以O2的体积分数为:
×100%=75%,
故答案为:75%.
故答案为:0.2NA;
(2)标准状况下,含有相同氧原子数的CO与CO2的物质的量之比为:2:1,体积之比为:2:1,
故答案为:2:1;
(3)5.4g铝离子的物质的量为:
| 5.4g |
| 27g/mol |
| 3 |
| 2 |
| 0.3mol |
| 0.2L |
故答案为:1.5mol/L;
(4)已知24gA和40gB恰好完全反应生成0.4molC和32gD,根据质量守恒定律可知,0.4molC的质量为:40g+24g-32g=32g,则C的摩尔质量为:
| 32g |
| 0.4mol |
故答案为:80g/mol;
(5)标准状况下,密度为1.25g/L的O2与CH4组成的混合气体中,混合气体的平均摩尔质量为:M=1.25g/L×22.4L/mol=28,设氧气的物质的量为x,甲烷的物质的量为y,则:
| 32x+16y |
| x+y |
| 3 |
| 1+3 |
故答案为:75%.
点评:本题考查物质的量的计算,把握质量与物质的量的关系、物质的构成及发生的化学反应为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是(g、l、s分别表示气体、液体、固体)( )
| A、2H2(g)+O2(g)=2H2O(1)2H2(g)+O2(g)=2H2O(g) | ||||
B、
| ||||
C、C(s)+
| ||||
| D、S(s)+O2(g)=SO2(g) S(g)+O2(g)=SO2(g) |
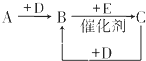 A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去). Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.
Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.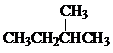 和
和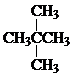
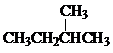 和
和