题目内容
12.实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+C12↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.请回答下列问题:
(1)该反应中氧化剂和还原剂的物质的量之比是1:2;
(2)用双线桥法表示该反应电子转移的方向和数目
 ;
;(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g•cm-3.为使用方便,请计算出该浓盐酸的物质的量浓度为11.9mol/L.
分析 (1)该反应中Mn元素化合价由+4价变为+2价、部分Cl元素化合价由-1价变为0价,所以二氧化锰是氧化剂、有一半的HCl作还原剂;
(2)该反应中转移电子数为2,Mn元素得电子、Cl元素失电子;
(3)c(HCl)=$\frac{1000ρω}{M}$.
解答 解:(1)该反应中Mn元素化合价由+4价变为+2价、部分Cl元素化合价由-1价变为0价,所以二氧化锰是氧化剂、有一半的HCl作还原剂,所以氧化剂和还原剂的物质的量之比为1:2,故答案为:1:2;
(2)该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,电子由失电子的HCl转移给得电子的二氧化锰,转移电子数为2,则电子转移方向和数目为 ,故答案为:
,故答案为: ;
;
(3)c(HCl)=$\frac{1000ρω}{M}$=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9 mol•L-1,
故答案为:11.9.
点评 本题考查氧化还原反应、物质的量浓度计算等知识点,侧重考查基本概念、基本计算,该反应中盐酸体现还原性和酸性,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 27克铝与足量的稀硫酸或氢氧化钠溶液充分反应,转移电子物质的量都为3 NA | |
| B. | 一瓶容积为22.4L 的NO2气体所含氮原子个数为NA | |
| C. | 浓度为0.2 mo1•L-1的CaC12溶液中,C1-离子的数目为0.4 NA | |
| D. | 标准状况下,22.4 L H2O含有的水分子数为NA |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4中共价键数目为4NA | |
| B. | 22.4 L O2和N2的混合气体中一定含有的原子数为2NA | |
| C. | 常温常压下,6 g NO2和40 g N2O4混合气体中的原子总数为3NA | |
| D. | 25℃时,1mol•L-1醋酸溶液中所含CH3COOH分子总数一定小于NA |
20.下列有关说法错误的是( )
| A. | 室温下的某 NaF 溶液中,c(H+)=1×10-10 mol?L-1,说明 NaF 使水的电离减弱 | |
| B. | Mg 在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 | |
| C. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 | |
| D. | 反应 N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
7.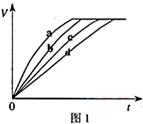 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能
( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能 | 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| A | 2.0 | 25 | 块状 |
| B | 2.5 | 30 | 块状 |
| C | 2.5 | 50 | 粉末状 |
| D | 2.5 | 50 | 块状 |
| A. | D-C-A-B | B. | C-D-B-A | C. | A-B-C-D | D. | A-B-D-C |
17.化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)-1.9KJ可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S(s)+O2(g)═SO2(g)+297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| D. | 在稀水溶液中 H+(aq)+OH-(aq)═H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的溶液混合时,放出的热量大于57.3 kJ |
4.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | 次氯酸电子式 | ||
| C. | F原子结构示意图: | D. | CH4分子的球棍模型: |
2.下列关于气体的实验室制取方法,说法正确的是( )
| A. | 可用加热试管中的NH4Cl制取NH3 | |
| B. | 可用MnO2固体和稀盐酸共热制取Cl2 | |
| C. | 可用炽热的碳和浓硫酸反应制取SO2 | |
| D. | 可用铝箔和NaOH溶液反应制取H2 |
 如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素.
如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素. ;
; +3HBr;
+3HBr; +H2O.
+H2O.