题目内容
15.有关热化学方程式书写与对应表述均正确的是( )| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
分析 A.醋酸是弱酸存在电离平衡,电离过程是吸热过程;
B.反应的焓变和化学方程式中物质的量有关,且吸热反应应该为“+”号;
C.依据n=$\frac{m}{M}$计算物质的量分析判断;
D.依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析.
解答 解:A.稀醋酸是弱酸电离过程是吸热过程,与0.1mol•L-1NaOH溶液反应放出的热量小于中和热,焓变是负值则:H+(aq)+OH-(aq)═H2O(l)△H>-57.3kJ•mol-1,故A错误;
B.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ•mol-1,故B错误;
C.密闭容器中,9.6g硫粉物质的量为0.3mol,与11.2g铁粉物质的量为0.2mol混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ热量,所以1mol铁反应放热=19.12kJ×$\frac{1mol}{0.2mol}$=95.6kJ,该热化学方程式为:Fe(s)+S(s)═FeS(s)△H=-95.6kJ•mol-1 ,
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳燃烧生成的一氧化碳不是稳定氧化物,故D错误;
故选C.
点评 本题考查热化学方程式,题目难度不大,明确燃烧热、中和热放热概念为解答关键,注意掌握热化学方程式的书写原则及表示意义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
1.下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是( )
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中.
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中.
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
6.下列说法中,正确的是( )
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
3.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 已知在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2 O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 |
10.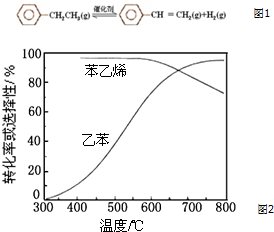 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:
(1)已知:
反应的△H=+124kJ•mol-1,X=412kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{α{\;}^{2}}{(1-α{\;}^{2})}p$(用α等符号表示),在平衡体系中充入氖气反应速率将减小(填“增大”“减小”“不变”).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图1:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(5)产物中另一种物质常用做燃料电池的材料,若电解质为熔融碳酸盐,其负极电极反应式为H2-2e-+CO32-=H2O+CO2↑.
 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:(1)已知:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{α{\;}^{2}}{(1-α{\;}^{2})}p$(用α等符号表示),在平衡体系中充入氖气反应速率将减小(填“增大”“减小”“不变”).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图1:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(5)产物中另一种物质常用做燃料电池的材料,若电解质为熔融碳酸盐,其负极电极反应式为H2-2e-+CO32-=H2O+CO2↑.
7.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
| A. | 两个羟基 | B. | 一个醛基 | C. | 两个醛基 | D. | 一个羟基 |
4.科学家人工合成的第一种有机物是( )
| A. | 酒精 | B. | 纤维素 | C. | 尿素 | D. | 橡胶 |
5.有机物Ⅰ和Ⅱ的结构式如下,下列说法中正确的是( )


| A. | Ⅰ和Ⅱ是同分异构体 | B. | Ⅰ和Ⅱ物理性质完全相同 | ||
| C. | Ⅰ和Ⅱ化学性质相同 | D. | Ⅰ和Ⅱ的分子式不相同 |