题目内容
7.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )| A. | 两个羟基 | B. | 一个醛基 | C. | 两个醛基 | D. | 一个羟基 |
分析 某芳香族有机物的分子式为C8H6O2,由分子式可知,该有机物分子含有一个苯环,去掉一个苯环后,还余有C2O2,剩余基团可能为2个 或1个
或1个 或1个C≡C、2个-O-,或1个-COO-、1个C,将其插入苯的C-H之间,判断可能形成的官能团.
或1个C≡C、2个-O-,或1个-COO-、1个C,将其插入苯的C-H之间,判断可能形成的官能团.
解答 解:某芳香族有机物的分子式为C8H6O2,由分子式可知,该有机物分子含有一个苯环,去掉一个苯环后,还余有C2O2,剩余基团可能为2个 或1个
或1个 或1个C≡C、2个-O-,将其插入苯的C-H之间,可以形成
或1个C≡C、2个-O-,将其插入苯的C-H之间,可以形成 ;
;
为1个-COO-、1个C,即分子拆除一个苯环和一个羧基后,还余有一个C,它不可能满足四价的结构而插入苯环的C-H键中,可以含2个羟基,也可以含两个醛基,不可能含一个羟基,故选D.
点评 本题考查有机物的结构方面的知识,注意知识的积累是解题的关键,题目难度中等,综合性较强.

练习册系列答案
相关题目
13.下列配制溶液的操作能引起浓度偏高的是( )
| A. | 用1g 98%的浓硫酸加入4g水配制1:4硫酸溶液 | |
| B. | 配制2.0mo1•L-1硫酸溶液时,最后在容量瓶中加水稀释到标线,塞好盖子倒转摇匀后,发现液面低于标线 | |
| C. | 在100mL无水乙醇中,加人2g甲醛配制2%的甲醛洒精溶液 | |
| D. | 在80mL水中,加入18.4mol•L-1浓硫酸20mL,配制3.68mol•L-1稀硫酸 |
18.磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
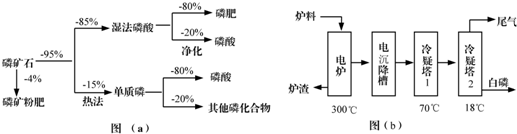
部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
15.有关热化学方程式书写与对应表述均正确的是( )
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
12.下列离子方程式书写正确的是( )
| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
19.下列说法正确的是( )
| A. | SiO2既能与HF反应,又能与NaOH反应,因此是两性氧化物 | |
| B. | SO2与Cl2均可漂白物质,将二者等物质的量混合,漂白效果会加强 | |
| C. | 将足量Na投入FeCl3溶液中,可将Fe3+直接还原为Fe单质 | |
| D. | 1 mol Na2O2与足量的CO2反应,转移电子的物质的量为1 mol |
16.A、B是同周期的非金属元素,若A的原子半径小于B的原子半径,则下列说法正确的是( )
| A. | A原子最外电子层上的电子数比B少 | |
| B. | B单质的氧化性大于A单质 | |
| C. | A的非金属性比B强 | |
| D. | B的气态氢化物稳定性大于A的气态氢化物 |
17.将20g Ba(OH)2•8H2O晶体与10g NH4Cl晶体一起放入小烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌晶体.则下列说法正确的是( )
| A. | 实验中玻璃棒的作用是加速固体溶解 | |
| B. | 玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 | |
| C. | 反应中断开化学键吸收的总能量低于形成化学键放出的总能量 | |
| D. | 该反应中,反应物的总能量小于生成物的总能量 |