题目内容
4.科学家人工合成的第一种有机物是( )| A. | 酒精 | B. | 纤维素 | C. | 尿素 | D. | 橡胶 |
分析 尿素是人工合成的第一种有机物,据此即可解答.
解答 解:1828年,维勒合成尿素,是人工合成的第一种有机物,
故选C.
点评 本题考查有机化学史,掌握尿素是人工合成的第一种有机物即可解答,题目较简单.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
14.某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷.
反应如下:NaBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
该兴趣小组要通过该实验检验反应的部分副产物,并探究溴乙烷的性质.
乙醇、溴乙烷和溴的有关数据见表:
(一)溴乙烷的制备及产物的检验:设计了如图1装置,其中夹持仪器、加热仪器及冷却水管没有画出.
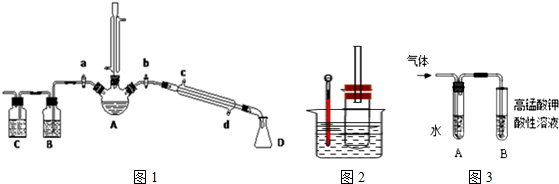
请根据实验步骤,回答下列问题:
(1)三颈烧瓶A上竖直冷凝管冷凝水流向下口进上口出;竖直冷凝管冷凝的作用冷凝回流
(2)反应时若温度过高三颈烧瓶A可看到有红棕色气体产生,该气体的化学式Br2;为了更好的控制反应温度,应采取的加热方式是水浴加热.
(3)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等.检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.
B、C中应盛放的试剂分别是四氯化碳、硝酸银溶液.
(4)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是A.(填字母)
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行蒸馏(填操作名称).
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10mL6mol/L NaOH溶液和2mL 溴乙烷,振荡.
II:将试管如图2固定后,水浴加热.
(5)观察到液体不分层现象时,表明溴乙烷与NaOH溶液已完全反应.
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图3装置.A试管中的水的作用是吸收乙醇,若无A试管,B试管中的试剂应为溴水.
反应如下:NaBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
该兴趣小组要通过该实验检验反应的部分副产物,并探究溴乙烷的性质.
乙醇、溴乙烷和溴的有关数据见表:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |

请根据实验步骤,回答下列问题:
(1)三颈烧瓶A上竖直冷凝管冷凝水流向下口进上口出;竖直冷凝管冷凝的作用冷凝回流
(2)反应时若温度过高三颈烧瓶A可看到有红棕色气体产生,该气体的化学式Br2;为了更好的控制反应温度,应采取的加热方式是水浴加热.
(3)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等.检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.
B、C中应盛放的试剂分别是四氯化碳、硝酸银溶液.
(4)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是A.(填字母)
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行蒸馏(填操作名称).
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10mL6mol/L NaOH溶液和2mL 溴乙烷,振荡.
II:将试管如图2固定后,水浴加热.
(5)观察到液体不分层现象时,表明溴乙烷与NaOH溶液已完全反应.
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图3装置.A试管中的水的作用是吸收乙醇,若无A试管,B试管中的试剂应为溴水.
15.有关热化学方程式书写与对应表述均正确的是( )
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
12.下列离子方程式书写正确的是( )
| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
19.下列说法正确的是( )
| A. | SiO2既能与HF反应,又能与NaOH反应,因此是两性氧化物 | |
| B. | SO2与Cl2均可漂白物质,将二者等物质的量混合,漂白效果会加强 | |
| C. | 将足量Na投入FeCl3溶液中,可将Fe3+直接还原为Fe单质 | |
| D. | 1 mol Na2O2与足量的CO2反应,转移电子的物质的量为1 mol |
9.已知氧的相对原子质量为16,用氢气还原氧化铜法测定铜的相对原子质量,实验数据如下:
则铜的相对原子质量为( )
| 空硬质玻璃管 | 硬质玻璃管+氧化铜 | 硬质玻璃管+铜 | |
| 质量(g) | w | m | n |
| A. | $\frac{16m}{m-n}$ | B. | $\frac{16(w-n)}{m-n}$ | C. | $\frac{16n}{m-n}$ | D. | $\frac{16(n-w)}{m-n}$ |
16.A、B是同周期的非金属元素,若A的原子半径小于B的原子半径,则下列说法正确的是( )
| A. | A原子最外电子层上的电子数比B少 | |
| B. | B单质的氧化性大于A单质 | |
| C. | A的非金属性比B强 | |
| D. | B的气态氢化物稳定性大于A的气态氢化物 |
14.某试剂能把乙醇、乙酸、葡萄糖溶液区别开,这种试剂是( )
| A. | 新制Cu(OH)2悬浊液 | B. | 溴水 | ||
| C. | 钠 | D. | 酸性高锰酸钾溶液 |
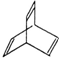 有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
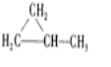
 、
、
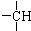 及一个-Cl,它的可能结构只有四种.请写出这四种可能的结构简式
及一个-Cl,它的可能结构只有四种.请写出这四种可能的结构简式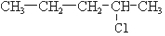 ②
②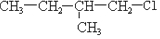
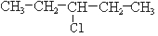 ④
④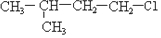 .
.