题目内容
2.高炉炼铁是冶炼铁的主要方法,发生的主要反应为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H(1)已知:Fe2O3(s)+3C(石墨,s)═2Fe(s)+3CO(g)△H1
C(石墨,s)+CO2(g)═2CO(g)△H2
则△H=△H1-3△H2(用含△H1、△H2代数式表示)
(2)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是B(填字母).
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率.
分析 (1)依据热化学方程式 和盖斯定律计算分析判断;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②A.反应前后气体系数相等,容器压强始终恒定;
B.反应前后气体质量变化,体积不变,则密度变化;
C.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率;
D.固体量增加不影响化学平衡.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1
②C(石墨)+CO2(g)=2CO(g)△H2
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=△H1-3△H2,
故答案为:△H1-3△H2;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=$\frac{c{\;}^{3}(CO{\;}_{2})}{c{\;}^{3}(CO)}$=$\frac{(1+x){\;}^{3}}{(1-x){\;}^{3}}$=64,计算得到x=0.6
转化率=60%
故答案为:60%;
②A.反应前后气体系数相等,容器压强始终恒定,不能标志反应达到平衡状态,故A错误;
B.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故B正确;
C.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,则甲容器中CO的平衡转化率等于乙的转化率,故C错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故D错误;
故答案为:B.
点评 本题考查了热化学方程式和盖斯定律计算应用,平衡移动及其计算应用,化学平衡三段式列式计算方法题目难度中等.

 教学练新同步练习系列答案
教学练新同步练习系列答案| A. | Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 | |
| B. | Na2O2、Cl2、SO2的漂白原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液,褪色更快 | |
| D. | 在Na2O2中阴、阳离子所含的电子数目相等 |
| A. | 离子晶体在熔化状态下能导电 | |
| B. | 在晶体中只要有阴离子就一定有阳离子 | |
| C. | 原子晶体中一定有非极性共价键 | |
| D. | 分子晶体中不一定含有共价键 |
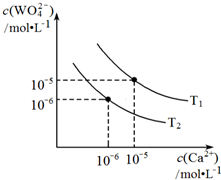 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:Ⅰ.WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq) K1
已知:反应Ⅰ的平衡常数K1理论值如下表
| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
(1)判断反应Ⅰ的△S>0、△H>0(填“>”、“=”或“<”),在较高(填“较高”或“较低”)温度下有利于该反应自发进行.
(2)氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,溶解度均随温度升高而减小.它们在水中存在如下沉淀溶解平衡:
Ⅱ.CaWO4(s)?Ca2+(aq)+WO42ˉ(aq) K2
Ⅲ.Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq) K3
①根据反应Ⅰ~Ⅲ,可推导出K1、K2与K3之间的关系,则K1=K1=$\frac{{K}_{3}}{{K}_{2}}$(用K2、K3表示).
②根据反应Ⅱ,图为不同温度下CaWO4的沉淀溶解平衡曲线.则T1<T2(填“>”“=”或“<”).T1时,向0.5mol•Lˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,此时溶液中c(Ca2+)=5×10ˉ10mol•Lˉ1.(假设反应前后体积不变)
(3)制取钨酸钙时,适时向反应混合液中添加适量的某种酸性物质,有利于提高WO42ˉ的转化率.反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3.
①在反应混合液中不直接通入CO2,其理由是碱性条件下CO2与Ca2+生成难溶物CaCO3,降低WO42ˉ的转化率;
②用平衡移动原理解释添加酸性物质的理由加入酸性物质与OHˉ反应,使溶液中OHˉ浓度减小,平衡向生成CaWO4的方向移动.
| 单质 | A | B | C | D | E |
| 最高价氧化物 对应水化物的稳定性 | 难分解 | 能分解 | 能分解 | 能分解 | 能分解 |
| 单质性质 | 与水剧烈反应 | 缓慢溶于热水 | 溶于强碱性溶液 | 难溶于冷的浓硝酸 | 溶于浓、稀硝酸 |
根据要求,回答下列问题:
(1)C元素最高价氧化物对应的水化物既能与酸反应,又能与碱反应,原因分别是:Al(OH)3?Al3++3OH-;Al(OH)3?H++AlO2-+H2O(用电离方程式表示)
(2)以B、C为电极,A的氢氧化物的水溶液为电解质溶液,构成原电池.写出C极的电极反应式:Al-3e-+4OH-=AlO2-+2H2O.
(3)用离子方程式表示D的单质能与D的化合物在水溶液中发生化合反应:Fe+2Fe3+=3Fe2+.
(4)E的单质在加热条件下能与浓硫酸反应,其反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
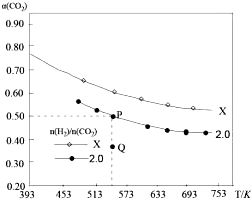 在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | X的氢碳比X>2.0,且Q点在氢碳比为2.0时v(正)<v(逆) | |
| C. | 若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得到P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
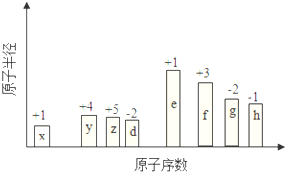 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.
.位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.