题目内容
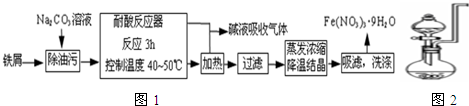
把少量废铁屑(含Al2O3、Fe2O3)溶于过量稀硫酸,过滤,向滤液中通入过量氯气,再加入过量的氢氧化钠溶液,有沉淀X生成,过滤,加热沉淀物至质量不再改变,得到残渣Y,上述沉淀X和残渣Y分别为 .
考点:镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:把少量废铁屑(含Al2O3、Fe2O3)溶于过量稀硫酸生成硫酸亚铁、硫酸铝和硫酸铁,过滤,除去杂质,向滤液中通入过量氯气,硫酸亚铁被氧化成硫酸铁,再加入过量的氢氧化钠溶液,因为氢氧化铝溶于氢氧化钠溶液,所以只有红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3,据此分析解答.
解答:
解:把少量废铁屑(含Al2O3、Fe2O3)溶于过量稀硫酸生成硫酸亚铁、硫酸铝和硫酸铁,过滤,除去杂质,向滤液中通入过量氯气,硫酸亚铁被氧化成硫酸铁,再加入过量的氢氧化钠溶液,因为氢氧化铝溶于氢氧化钠溶液,所以只有红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3,有关反应为:Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;2Fe2++Cl2═2Fe3++2Cl-、Fe3++3OH-=Fe (OH)3↓、Al3++4OH-=AlO2-+2H2O;2Fe(OH)3
Fe2O3+3H2O,所以沉淀X和残渣Y分别为Fe(OH)3和Fe2O3,
故答案为:Fe(OH)3和Fe2O3.
| ||
故答案为:Fe(OH)3和Fe2O3.
点评:本题考查铁及铁的化合物的性质,掌握铁及其氢氧化物的化学性质是解答的关键,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
在化学反应CO2+3H2?CH3OH+H2O中,下列措施中能使平衡混合物中
增大的是( )
| n(CH3OH) |
| n(CO2) |
| A、加入催化剂 |
| B、充入He(g),使体系压强增大 |
| C、将H2O(g)从体系中分离 |
| D、降低温度 |
 在体积为VL的恒容密闭容器中盛有一定量的H2,通往Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.平衡时H2的体积分数与所加入Br2(g)的物质的量变化关系如图所示,下列说法正确的是( )
在体积为VL的恒容密闭容器中盛有一定量的H2,通往Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.平衡时H2的体积分数与所加入Br2(g)的物质的量变化关系如图所示,下列说法正确的是( )| A、由图可知:T1<T2 |
| B、a,b两点的反应速率:a>b |
| C、为了提高Br2的转化率,可采取将HBr及时移走 |
| D、T1时,随着Br2加入,平衡时Br2的转化率增大 |
下列说法正确的是( )
| A、脱脂棉的主要成分是纤维素,人造丝和蚕丝的主要成分都是蛋白质 |
| B、淀粉、油脂、蛋白质都是高分子化合物,在一定条件下都能发生水解 |
| C、肽链通过氢键按一定的规律卷曲或折叠形成的空间结构称为蛋白质的二级结构 |
| D、淀粉与稀硫酸混合加热后,加入新制氢氧化铜加热,可检验淀粉是否已水解 |
浓度为0.1mol/L的(NH4)2SO4溶液中各种离子浓度的大小顺序正确的是( )
| A、C(SO42-)>C(NH4+)>C(OH-)>C(H+) |
| B、C(NH4+)>C(SO42-)>C(H+)>C(OH-) |
| C、C(SO42-)>C(NH4+)>C(H+)>C(OH-) |
| D、C(SO42-)>C(H+)>C(NH4+)>C(OH-) |
 某样品为Na2CO3和NaHCO3固体混合物,现将一定质量的样品与稀盐酸反应,用测定生成CO2体积的方法计算出样品中各组分的质量分数.为较准确地测出生成CO2的体积,在反应结束后加热反应混合物,使溶于溶液中的CO2逸出,待冷却至室温后测CO2的体积(加热时蒸发的水的体积忽略不计).如图是实验装置图,其中,B和C可供选择.请回答下列问题:
某样品为Na2CO3和NaHCO3固体混合物,现将一定质量的样品与稀盐酸反应,用测定生成CO2体积的方法计算出样品中各组分的质量分数.为较准确地测出生成CO2的体积,在反应结束后加热反应混合物,使溶于溶液中的CO2逸出,待冷却至室温后测CO2的体积(加热时蒸发的水的体积忽略不计).如图是实验装置图,其中,B和C可供选择.请回答下列问题: