题目内容
铁及其化合物在日常生活中应用广泛,请回答下列问题:
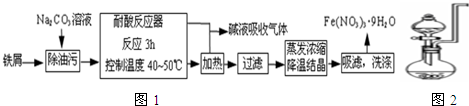
(1)Fe(NO3)3?9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂.工业上用细铁屑与稀硝酸反应制备,主要流程如图1:
①Na2CO3溶液可以除油污,原因是(用离子方程式表示): ;
②耐酸反应器中可以观察到的现象是 ;制备过程中需控制加入铁屑的量,当观察到 的现象时应停止加入铁屑;
③制得的Fe(NO3)3?9H2O用20% HNO3洗涤,其原因是 ;
④若在实验室中进行蒸发浓缩、降温结晶的操作,则所需的仪器有 ;
(2)某兴趣小组在实验室用图2装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①装置中圆底烧瓶上方长导管的作用是 ;
②烧瓶中发生反应的离子方程式: ;
(1)Fe(NO3)3?9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂.工业上用细铁屑与稀硝酸反应制备,主要流程如图1:
①Na2CO3溶液可以除油污,原因是(用离子方程式表示):
②耐酸反应器中可以观察到的现象是
③制得的Fe(NO3)3?9H2O用20% HNO3洗涤,其原因是
④若在实验室中进行蒸发浓缩、降温结晶的操作,则所需的仪器有
(2)某兴趣小组在实验室用图2装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①装置中圆底烧瓶上方长导管的作用是
②烧瓶中发生反应的离子方程式:

考点:制备实验方案的设计
专题:
分析:(1)①碳酸钠在溶液中水解显碱性,可以除油污;
②金属铁可以和稀硝酸反应生成硝酸铁、一氧化氮和水;要制得Fe3+,故加入的铁粉的量不能过量,否则会生成Fe2+,可以观察反应的气泡,也可以依据反应溶液的颜色变化判断;
③洗涤晶体表面的杂质,降低晶体溶解性,减少晶体损耗;
④蒸发浓缩、降温结晶的操作,所需仪器:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳,据此回答;
(2)①依据反应物的性质可知易挥发出的物质可以利用长玻璃管冷凝回流提高反应物的利用率,同时起到导气的作用;
②稀硝酸与Fe反应生成Fe(NO3)3、NO和水.
②金属铁可以和稀硝酸反应生成硝酸铁、一氧化氮和水;要制得Fe3+,故加入的铁粉的量不能过量,否则会生成Fe2+,可以观察反应的气泡,也可以依据反应溶液的颜色变化判断;
③洗涤晶体表面的杂质,降低晶体溶解性,减少晶体损耗;
④蒸发浓缩、降温结晶的操作,所需仪器:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳,据此回答;
(2)①依据反应物的性质可知易挥发出的物质可以利用长玻璃管冷凝回流提高反应物的利用率,同时起到导气的作用;
②稀硝酸与Fe反应生成Fe(NO3)3、NO和水.
解答:
解:(1)①碳酸钠在溶液中水解显碱性,可以除油污,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
②金属铁可以和稀硝酸反应生成硝酸铁、一氧化氮和水,硝酸铁溶液显示黄色,一氧化氮遇到氧气即变为二氧化氮红棕色的气体,要制得Fe3+,故加入的铁粉的量不能过量,否则会生成Fe2+,反应器中产生气泡的速率明显变慢,停止加入铁屑,
故答案为:铁屑溶解,溶液变为黄色,有无色气体产生,在液面上气体变为红棕色(后又变为无色);反应器中产生气泡的速率明显变慢;
③Fe(NO3)3?9H2O易溶于水,微溶于硝酸,制得的Fe(NO3)3?9H2O用20%HNO3洗涤的目的是洗去晶体表面的杂质,减少晶体损耗,
故答案为:洗涤除去晶体表面附着的杂质,用20%HNO3洗涤可降低洗涤过程中晶体的损耗;
④蒸发浓缩、降温结晶的操作,所需仪器:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳,
故答案为:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳;
(2)①硝酸易挥发,挥发出的硝酸可以利用长玻璃管冷凝回流提高反应物的利用率,同时起到导气的作用,故答案为:导气兼冷凝回流;
②稀硝酸与Fe反应生成Fe(NO3)3、NO和水,其反应的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O;
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O.
故答案为:CO32-+H2O?HCO3-+OH-;
②金属铁可以和稀硝酸反应生成硝酸铁、一氧化氮和水,硝酸铁溶液显示黄色,一氧化氮遇到氧气即变为二氧化氮红棕色的气体,要制得Fe3+,故加入的铁粉的量不能过量,否则会生成Fe2+,反应器中产生气泡的速率明显变慢,停止加入铁屑,
故答案为:铁屑溶解,溶液变为黄色,有无色气体产生,在液面上气体变为红棕色(后又变为无色);反应器中产生气泡的速率明显变慢;
③Fe(NO3)3?9H2O易溶于水,微溶于硝酸,制得的Fe(NO3)3?9H2O用20%HNO3洗涤的目的是洗去晶体表面的杂质,减少晶体损耗,
故答案为:洗涤除去晶体表面附着的杂质,用20%HNO3洗涤可降低洗涤过程中晶体的损耗;
④蒸发浓缩、降温结晶的操作,所需仪器:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳,
故答案为:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳;
(2)①硝酸易挥发,挥发出的硝酸可以利用长玻璃管冷凝回流提高反应物的利用率,同时起到导气的作用,故答案为:导气兼冷凝回流;
②稀硝酸与Fe反应生成Fe(NO3)3、NO和水,其反应的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O;
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O.
点评:本题考查了物质制备实验的设计和分析,题目涉及的知识点较多,侧重于实验能力和分析能力的考查,注意把握流程中的反应条件和反应实质理解是解题关键,题目难度中等.

练习册系列答案
相关题目
咖啡酸具有止血功效,存在于多种中药中,其结构简式如图,则下列有关说法正确的是( )


| A、该物质中苯环上一氯代物有2种 |
| B、1mol该物质可以与1.5mol碳酸钠溶液反应生成1.5mol的CO2 |
| C、既能发生取代反应,也能发生加成反应 |
| D、所有碳原子不可能都在同一平面上 |
选用下列试剂和分离方法能实现除杂(括号内为杂质)目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 硬脂酸钠(甘油、水) | 氯化钠粉末 | 分液 |
| D | 福尔马林(蚁酸) | 饱和Na2CO3溶液 | 蒸馏 |
| A、A | B、B | C、C | D、D |
某温度下,在一体积为2L的密闭容器中,通入112g N2 和24g H2,此时容器内压强为p大气压,在该温度和催化剂作用下,H2和N2 反应达到平衡,测得平衡时压强为0.95大气压,下列说法不正确的是( )
| A、平衡时,N2的物质的量是3.6mol |
| B、平衡时,H2的物质的量是10.8mol |
| C、平衡时,N2的转化率为10% |
| D、NH3的体积百分含量是10% |
β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1,下列说法不正确的是( )


| A、维生素A1难溶于水,也难溶于NaOH溶液 |
| B、β-紫罗兰酮与中间体X互为同系物 |
| C、1molβ-紫罗兰酮与1molCl2发生加成反应可得到3种不同产物 |
| D、β-紫罗兰酮能发生加成反应、取代反应、氧化反应、还原反应、加聚反应 |
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全恢复的是( )
| A、CuCl2(CuO) |
| B、NaOH(NaOH) |
| C、CuSO4[Cu (OH)2] |
| D、NaCl(HCl) |
