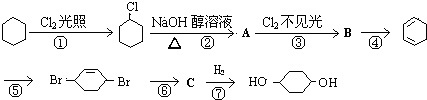
题目内容
常温下HCN、HClO的电离常数分别为5×10-10、3×10-8.则:
(1)HCN的结构式为 .HClO的电离方程式为 .
(2)同为0.1mol/L的NaCN、NaClO溶液中,阴、阳离子物质的量浓度之和的大小关系为 (填序号:A.前者大 B.后者大 C.一样大 D.不能确定)
(3)关于等体积、等物质的量浓度的HCN与NaCN两种溶液混合所得的溶液,下列说法错误的是
A.c(CN-)>c(Na+)>c(H+)>c(OH-)
B.c(Na+)>c(CN-)>c(OH-)>c(H+)
C.c(Na+)+c(H+)=c(CN-)+c(OH-)
D.c(OH-)=c(H+)+c(HCN)
E.c(OH-)+c(CN-)>c(H+)+c(HCN)
(1)HCN的结构式为
(2)同为0.1mol/L的NaCN、NaClO溶液中,阴、阳离子物质的量浓度之和的大小关系为
(3)关于等体积、等物质的量浓度的HCN与NaCN两种溶液混合所得的溶液,下列说法错误的是
A.c(CN-)>c(Na+)>c(H+)>c(OH-)
B.c(Na+)>c(CN-)>c(OH-)>c(H+)
C.c(Na+)+c(H+)=c(CN-)+c(OH-)
D.c(OH-)=c(H+)+c(HCN)
E.c(OH-)+c(CN-)>c(H+)+c(HCN)
考点:离子积常数,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据稳定结构进行判断;HClO为弱电解质;
(2)常温下HCN、HClO的电离常数分别为5×10-10、3×10-8,NaCN水解程度大于NaClO程度;
(3)HCN的电离常数为5×10-10,HCN与NaCN两种溶液混合所得的溶液呈电中性,等体积、等物质的量浓度的HCN与NaCN两种溶液混合所得的溶液呈碱性.
(2)常温下HCN、HClO的电离常数分别为5×10-10、3×10-8,NaCN水解程度大于NaClO程度;
(3)HCN的电离常数为5×10-10,HCN与NaCN两种溶液混合所得的溶液呈电中性,等体积、等物质的量浓度的HCN与NaCN两种溶液混合所得的溶液呈碱性.
解答:
解:(1)氢原子最外层有1个电子成1个共价键,碳原子最外层有4个电子,成4个共价键,氮原子最外层有5个电子,成3个共价键,故HCN的结构式为H-C≡N,HClO的电离方程式为 HClO?H++ClO-,故答案为:H-C≡N;HClO?H++ClO-;
(2)常温下HCN、HClO的电离常数分别为5×10-10、3×10-8,NaCN水解程度大于NaClO程度,NaClO溶液中,阴、阳离子物质的量浓度之和大,故答案为:B;
(3)等体积、等物质的量浓度的HCN与NaCN两种溶液混合所得的溶液,根据电荷守恒,存在c(H+)+c(Na+)=c(OH-)+c(CN-),故C正确;
又由于c(OH-)>c(H+),即存在关系c(Na+)>c(CN-)>c(OH-)>c(H+),故A错误,B正确;
根据物料守恒,2c(Na+)=c(CN-)+c(HCN),结合电荷守恒c(H+)+c(Na+)=c(OH-)+c(CN-),得到关系 c(OH-)+c(Na+)=c(H+)+c(HCN),故D错误;
因为c(Na+)>c(CN-),c(OH-)+c(Na+)=c(H+)+c(HCN),所以有关系c(OH-)+c(CN-)<c(H+)+c(HCN),故E错误;
由上分析,知A、D、E错误,B、C正确,
故答案为:A、D、E.
(2)常温下HCN、HClO的电离常数分别为5×10-10、3×10-8,NaCN水解程度大于NaClO程度,NaClO溶液中,阴、阳离子物质的量浓度之和大,故答案为:B;
(3)等体积、等物质的量浓度的HCN与NaCN两种溶液混合所得的溶液,根据电荷守恒,存在c(H+)+c(Na+)=c(OH-)+c(CN-),故C正确;
又由于c(OH-)>c(H+),即存在关系c(Na+)>c(CN-)>c(OH-)>c(H+),故A错误,B正确;
根据物料守恒,2c(Na+)=c(CN-)+c(HCN),结合电荷守恒c(H+)+c(Na+)=c(OH-)+c(CN-),得到关系 c(OH-)+c(Na+)=c(H+)+c(HCN),故D错误;
因为c(Na+)>c(CN-),c(OH-)+c(Na+)=c(H+)+c(HCN),所以有关系c(OH-)+c(CN-)<c(H+)+c(HCN),故E错误;
由上分析,知A、D、E错误,B、C正确,
故答案为:A、D、E.
点评:本题考查了弱电解质的电离及盐类水解,明确酸的强弱与酸根离子水解程度关系是解本题关键.

练习册系列答案
相关题目
下列反应中符合下列图象的是( )
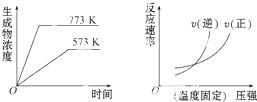

| A、N2(g)+3H2(g)?2NH5(g)△H=-Q1kJ?mol-1(Q1>0) |
| B、2SO5(g)?2SO2(g)+O2(g)△H=+Q2kJ?mol-1(Q2>0) |
| C、4NH5(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q3kJ?mol-1(Q3>0) |
| D、H2(g)+CO(g)?C(g)+H2O(g)△H=+Q4kJ?mol-1(Q4>0) |