题目内容
(1)NH3?H2O是一元碱,其电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵溶液呈中性),C(OH-) (填“增大”“减小”“不变”).
(2)已知某温度下Kb(NH3?H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中c(OH-)= mol/L;
(3)又已知该温度下Ksp[Mg(OH)2]=1.2×10-11,将0.01mol/L的MgCl2溶液与上述氨水等体积混合 (填“有”“无”)沉淀生成,往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH=10此时c(Mg2+)= mol/L.
(2)已知某温度下Kb(NH3?H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中c(OH-)=
(3)又已知该温度下Ksp[Mg(OH)2]=1.2×10-11,将0.01mol/L的MgCl2溶液与上述氨水等体积混合
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)NH3?H2O 是弱电解质存在电离平衡,往氨水中加入少量醋酸铵固体,醋酸铵呈中性,溶液中氢氧根离子浓度不变;
(2)依据平衡常数概念计算;
(3)依据溶度积常数计算分析判断,等体积混合,离子浓度变化为原来一半,结合浓度积和Ksp比较判断,碱溶液中镁离子完全沉淀,镁离子.
(2)依据平衡常数概念计算;
(3)依据溶度积常数计算分析判断,等体积混合,离子浓度变化为原来一半,结合浓度积和Ksp比较判断,碱溶液中镁离子完全沉淀,镁离子.
解答:
解:(1)NH3?H2O 是弱电解质存在电离平衡,NH3?H2O?NH4++OH-,往氨水中加入少量醋酸铵固体,醋酸铵呈中性,溶液中铵根离子浓度增大,平衡左移,氢氧根离子浓度减小;
故答案为:NH3?H2O?NH4++OH-;减小;
(2)某温度下NH3?H2O?NH4++OH-,K(NH3?H2O)=
=1.69×10-5,则该温度下0.1mol/L的氨水中c(OH-)=
=1.3×10-2mol/L;
故答案为:1.3×10-2;
(3)将0.01mol/L的MgCl2溶液与上述氨水等体积混合,浓度商=0.005mol/L×(
)2=2.1×10-7<Ksp,有沉淀生成,往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH=10,此时c(Mg2+)=
=1.2×10-3mol/L,
故答案为:有;1.2×10-3.
故答案为:NH3?H2O?NH4++OH-;减小;
(2)某温度下NH3?H2O?NH4++OH-,K(NH3?H2O)=
c(OH-)c
| ||
| c(NH3?H2O) |
|
故答案为:1.3×10-2;
(3)将0.01mol/L的MgCl2溶液与上述氨水等体积混合,浓度商=0.005mol/L×(
| 1.3×10-2 |
| 2 |
| 1.2×10-11 |
| (10-4)2 |
故答案为:有;1.2×10-3.
点评:本题考查了弱电解质电离,沉淀溶解平衡的分析判断,溶度积常数计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
将足量CO2通入下列各溶液中,所含离子或分子还能大量共存的一组微粒是( )
| A、K+、MnO4-、SO42-、H2SO3 |
| B、Na+、SiO32-、Cl-、NO3- |
| C、H+、Al3+、SO42-、NH4+ |
| D、Na+、S2-、H+、S2O32- |
Mg、Cu和Al三种金属粉末的混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量NaOH溶液,再过滤,滤液中存在的离子有( )
| A、AlO2- |
| B、Al3+ |
| C、Mg2+ |
| D、Cu2+ |
下列推断正确的是( )
| A、金属单质与盐溶液的反应都是置换反应 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| D、C、N、S三种单质直接与O2反应都能生成两种以上氧化物 |
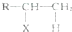 .A、B、C、D、E、M、N有下列转化关系:
.A、B、C、D、E、M、N有下列转化关系: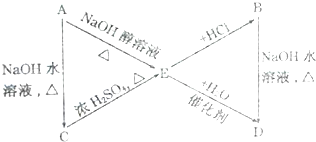
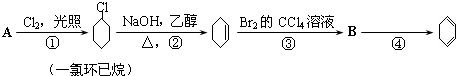
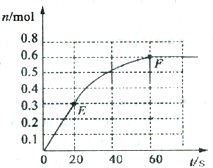 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示. (1)甲醇是一种优质燃料,可制作燃料电池,工业上可用下列两种反应制备甲醇:
(1)甲醇是一种优质燃料,可制作燃料电池,工业上可用下列两种反应制备甲醇: