题目内容
8.某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳元素的质量分数是64.86%,氢元素的质量分数是13.51%,则其实验式是C4H10O.分析 碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是21.63%,计算该物质中碳、氢、氧原子个数,可确定实验式.
解答 解:碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是1-64.86%-13.51%=21.63%,则该物质中碳、氢、氧原子个数之比=$\frac{64.86%}{12}$:$\frac{13.51%}{1}$:$\frac{21.63%}{16}$=4:10:1,所以其实验式为:C4H10O,
故答案为:C4H10O.
点评 本题考查了有机物分子式与结构的确定,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意实验式的确定方法.

练习册系列答案
相关题目
18.下列反应的离子方程式正确是( )
| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| B. | 氯化银溶于浓氨水:AgCl+2NH3•H2O=[Ag(NH3)2]Cl+2H2O | |
| C. | 工业上制取漂白粉:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | NaNO2溶液中加入酸性高锰酸钾溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
19. 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:
N2(g)+O2(g)═2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为(1.5c-a-b)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.02 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如表:
表中a、b、80%三者的大小关系为80%<a=b或80%<a<b.(填“>”、“=”、“<”、“无法比较”)
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在图2中画出平衡常数K随时间的变化曲线.
 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:
N2(g)+O2(g)═2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为(1.5c-a-b)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.02 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如表:
 | 1小时 | 2 小时 | 3小时 | 4小时 |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在图2中画出平衡常数K随时间的变化曲线.
16. 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )| A. | 当溶液pH=3.76时,c(CH3COOH)>c(CH3COO-) | |
| B. | 当溶液pH=4.76时,c(CH3COO-)=c(CH3COOH)>c(OH-)=c(H+) | |
| C. | 当溶液pH=5.76时,CH3COO-的物质的量分数约为0.91 | |
| D. | 当溶液3<pH<7时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=10(pH-pKa) |
3.原子序数依次递增的四种短周期元素X、Y、Z、M,其中X和Z、Y和M分别同主族,Z和M同周期,X、Y、Z均不同周期,M的核电荷数是Y的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Z>X | |
| B. | 气态氢化物的稳定性:M>Y | |
| C. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| D. | 在X2M与Z2M的溶液中,水的电离程度,前者大于后者 |
13.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚与碳酸钠溶液反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]+$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
20.能证明乙酸是弱酸的实验事实是( )
| A. | CH3COOH溶液与Zn反应放出H2 | |
| B. | 0.1 mol/L CH3COONa溶液的pH大于7 | |
| C. | CH3COOH溶液与Na2CO3反应生成CO2 | |
| D. | 0.1 mol/L CH3COOH溶液可使紫色石蕊变红 |
17.下列物质不可能是烯烃加成产物的是( )
| A. | CH2ClCH3 | B. | CH3CH3 | C. |  | D. |  |
 ;
;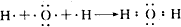 ;
;