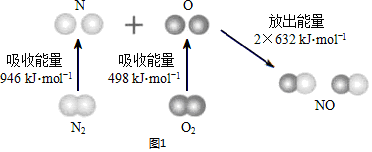
题目内容
6.下列转化关系所涉及的物质都是中学化学常见物质.已知A、B为氧化物,C为固体单质,D为黄绿色气体.
请回答:
(1)指出A中存在的化学键类型:离子键.
(2)写出M与过量氨水反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸.观察到的现象是有白色沉淀生成,加HCl后沉淀全部溶解,同时产生气泡.写出涉及的反应方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3、Al(OH)3+3HCl=AlCl3+3H2O、NHCO3+HCl=CO2↑+H2O+NaCl.
(4)B与浓酸X反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 C可用电解法生成,且与浓硝酸物明显现象,应为Al,则A为Al2O3,E为O2,D为黄绿色气体,应为Cl2,则B为MnO2,由转化关系可知M为AlCl3,G为Al(OH)3,N为NaAlO2,X为HCl,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)A为Al2O3,为离子化合物,含有离子键,故答案为:离子键;
(2)M为AlCl3,与过量氨水反应生成Al(OH)3,Al(OH)3不溶于弱碱,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)向溶液NaAlO2中先通入过量二氧化碳,可生成氢氧化铝和碳酸氢钠,发生反应的方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再加入过量稀盐酸,发生Al(OH)3+3HCl=AlCl3+3H2O,NHCO3+HCl=CO2↑+H2O+NaCl,
故答案为:有白色沉淀生成,加HCl后沉淀全部溶解,同时产生气泡;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3、Al(OH)3+3HCl=AlCl3+3H2O、NHCO3+HCl=CO2↑+H2O+NaCl;
(4)B为MnO2,与浓盐酸在加热条件下生成氯化锰、氯气和水,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题综合考查无机物的推断,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,把握物质的性质以及反应的现象,难度不大.

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的NO b.通入一定量的N2 c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是cd (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=1.25mol/L.NO的转化率不变(填“增大”、“减小”或“不变”).
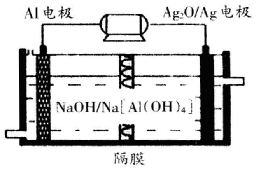
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示
请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=2(不考虑溶液体积的变化).
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 纯碱可用于生产普通玻璃,也可用来治疗胃酸过多的病症 |
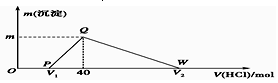
| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
| A. | O2是氧化剂,S2O32-、Fe2+ 是还原剂 | |
| B. | 当有1 mol Fe3O4生成时共转移的电子为4mol | |
| C. | 若有3mol Fe2+ 参加反应,则被Fe2+还原的O2为1mol | |
| D. | 若有2mol Fe2+ 被氧化,则被Fe2+还原的O2为0.5mol |
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |