题目内容
1.下列说法不正确的是( )| A. | Na2O的熔点高于K2S,是因为Na2O晶格能大 | |
| B. | 共用电子对不发生偏移的共价键是非极性键 | |
| C. | Na、Mg、Al第一电离能大小顺序:Na<Mg<Al | |
| D. | HCl极易溶于水,是因为它们的分子均为极性分子 |
分析 A.结构相似的晶体,离子半径越小,晶格能越大;
B.非极性键的共用电子对不偏向任何一方;
C.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
D.根据相似相溶的原理判断.
解答 解:A.Na2O、K2S结构相似,钠离子、氧离子的半径分别比钾离子、硫离子小,离子半径越小,晶格能越大,故A正确;
B.形成非极性键的两个原子相同,共用电子对不偏向任何一方,为非极性键,故B正确;
C.同一周期元素的第一电离能随着原子序数的增大而增大,同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能Na<Al<Mg,故C错误;
D.HCl为极性分子,水为极性分析,相似相溶,HCl极易溶于水,故D正确.
故选C.
点评 本题考查较为综合,涉及晶格能、共价键、电离能以及相似相溶原理等知识,为高频考点,侧重于双基的考查,注意把握物质的结构与性质的关系,把握元素周期率,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
11.如图为一重要的有机化合物,以下关于它的说法中正确的是( )


| A. | 它是芳香烃 | |
| B. | 1mol该物质,最多可以与1mol H2发生加成反应 | |
| C. | 与1mol该物质反应,消耗Na、NaOH、NaHCO3 的物质的量之比为2:1:1 | |
| D. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
12.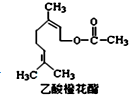 乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
 乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | 它的同分异构体中可能有芳香族化合物 | |
| B. | 能发生加成反应,但不能发生取代反应 | |
| C. | lmol该有机物在一定条件下和H2反应,共消耗H2为3mol | |
| D. | lmol该有机物水解时只能消耗lmo1NaOH |
9.下列无法证明某酸HA是弱酸的实验方案是( )
| A. | 室温下,用PH试纸测得0.1mol•L-1 NaA溶液的PH>7 | |
| B. | 碳酸钠溶液中滴入0.1mol•L-1的HA溶液,产生大量无色气体 | |
| C. | 室温下测得某HA溶液的PH=a,用蒸馏水稀释100倍测得溶液PH=b,且b-a<2 | |
| D. | 室温下,测得0.1mol•L-1HA溶液的PH>1,证明HA是弱酸 |
6.等温、等压下,同体积的A、B两种气体的质量比为23:16,若B的相对分子质量为32,则A的化学式为( )
| A. | NO2 | B. | NO | C. | N2O3 | D. | N2O5 |
13.用NA表示阿伏加德罗常数的值.下列说法中,不正确的是( )
| A. | 32g氧气含有2NA个氧原子 | |
| B. | 32g臭氧含有2NA个氧原子 | |
| C. | 32g氧气和臭氧的混合气体中含有2NA个氧原子 | |
| D. | 32g氧气和臭氧的混合气体含有NA个氧原子 |
14.“pp”塑料(聚丙烯)是保鲜盒的材料,用1-丙醇制取 ,可能遇到的反应类型是( )
,可能遇到的反应类型是( )
 ,可能遇到的反应类型是( )
,可能遇到的反应类型是( )| A. | 取代 | B. | 消去 | C. | 缩聚 | D. | 氧化 |
 .
.