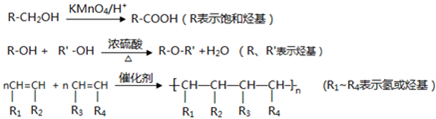
题目内容
关于小苏打水溶液的表述正确的是( )
| A、c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、HCO3-的电离程度大于HCO3-水解程度 |
| D、存在的电离有NaHCO3=Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:A.小苏打为碳酸氢钠,从物料守恒的角度分析;
B.根据碳酸氢钠溶液的电中性原则分析;
C.NaHCO3溶液呈碱性,HCO3-的水解大于HCO3-的电离;
D.碳酸氢钠溶液中存在碳酸氢钠的电离、碳酸氢根离子的电离和水的电离平衡.
B.根据碳酸氢钠溶液的电中性原则分析;
C.NaHCO3溶液呈碱性,HCO3-的水解大于HCO3-的电离;
D.碳酸氢钠溶液中存在碳酸氢钠的电离、碳酸氢根离子的电离和水的电离平衡.
解答:
解:A.NaHCO3溶液中根据物料守恒可知,溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故A错误;
B.溶液存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C.NaHCO3溶液呈碱性,HCO3-的水解大于HCO3-的电离,故C错误;
D.碳酸氢钠溶液中存在的电离平衡有:NaHCO3=Na++HCO3-、HCO3-?CO32-+H+、H2O?H++OH-,故D正确;
故选D.
B.溶液存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C.NaHCO3溶液呈碱性,HCO3-的水解大于HCO3-的电离,故C错误;
D.碳酸氢钠溶液中存在的电离平衡有:NaHCO3=Na++HCO3-、HCO3-?CO32-+H+、H2O?H++OH-,故D正确;
故选D.
点评:本题考查溶液中离子浓度大小比较、盐的水解原理等知识,题目难度中等,侧重于学生的分析、理解能力的考查,注意把握盐类水解的原理和规律,能够根据电荷守恒、物料守恒等知识判断溶液中离子浓度大小.

练习册系列答案
相关题目
断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )


| A、②中所含官能团种类比③中多 |
| B、①、④互为同系物 |
| C、①、②、③、④均能与氢氧化钠溶液反应 |
| D、等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12.将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )
| A、c(B+)>c(A-)>c(OH-)>c(H+) |
| B、c(A-)>c(B+)>c(H+)>c(OH-) |
| C、c(B+)=c(A-)>c(H+)=c(OH-) |
| D、c(B+)>c(A-)>c(H+)>c(OH-) |
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ?mol-1mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |
下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的是( )
①NaHCO3②Al ③Al2O3④Al(OH)3⑤NaAlO2.
①NaHCO3②Al ③Al2O3④Al(OH)3⑤NaAlO2.
| A、全部 | B、②③⑤ |
| C、①③⑤ | D、①②③④ |
下列试剂的保存方法,错误的是( )
| A、把浓硝酸放在棕色瓶中,并置于冷暗处保存 |
| B、把AgNO3放在棕色瓶中保存 |
| C、把NaOH溶液放在带橡皮塞的玻璃瓶中 |
| D、把氢氟酸放在玻璃瓶中,把Na保存在煤油中 |
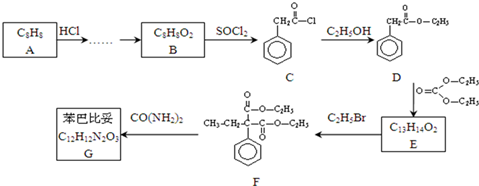



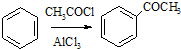 ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物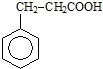 为原料合成
为原料合成 (用合成路线流程图表示为:A
(用合成路线流程图表示为:A