题目内容
下列叙述正确的是( )
| A、10 mL O.1 mol?L-1NH4C1溶液与5 mL、0.2 mol?L-1NaOH溶液混合:c(Na+)=c(C1-)>c(OH-)>c(NH4+)>c(H+) |
| B、0.1 mol.L-1 pH=4的NaHB的溶液中,c(Na+)>c(HB-) c(H2B)>c(B2-) |
| C、常温时,NaHC03溶液中:c(Na+)=c(HC03-)+c(H2 CO3) |
| D、相同条件下,pH=5的①NH4C1溶液、②CH3COOH溶液、③稀盐酸中由水电离出的c(H+):①>②>③ |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、混合后为氯化钠和氨水,显碱性;
B、电离程度>水解程度,c(B2-)>c(H2B);
C、NaHC03溶液中:c(Na+)等于未变化的c(HC03-),HC03- 水解一部分成H2 CO3,电离一部分成碳酸根离子;
D、相同条件下,pH=5的溶液c(H+)=10-5mol/L; c(OH-)=10-9mol/L; OH-全部为水电离出来的,均相同.
B、电离程度>水解程度,c(B2-)>c(H2B);
C、NaHC03溶液中:c(Na+)等于未变化的c(HC03-),HC03- 水解一部分成H2 CO3,电离一部分成碳酸根离子;
D、相同条件下,pH=5的溶液c(H+)=10-5mol/L; c(OH-)=10-9mol/L; OH-全部为水电离出来的,均相同.
解答:
解:A、混合后为氯化钠和氨水,显碱性,溶液中离子浓度大小为:c(Na+)=c(C1-)>c(OH-)>c(NH4+)>c(H+),故A正确;
B、pH=4的NaHB的溶液中,电离程度>水解程度,c(B2-)>c(H2B),故B错误;
C、NaHC03溶液中:c(Na+)等于未变化的c(HC03-),存在物料守恒,HC03- 水解一部分成H2 CO3,电离一部分成碳酸根离子,c(Na+)=c(HC03-)+c(H2 CO3)+c(CO32-),故C错误;
D、相同条件下,pH=5的溶液c(H+)=10-5mol/L; c(OH-)=10-9mol/L; OH-全部为水电离出来的,均相同,c(H+):①=②=③,故D错误;
故选A.
B、pH=4的NaHB的溶液中,电离程度>水解程度,c(B2-)>c(H2B),故B错误;
C、NaHC03溶液中:c(Na+)等于未变化的c(HC03-),存在物料守恒,HC03- 水解一部分成H2 CO3,电离一部分成碳酸根离子,c(Na+)=c(HC03-)+c(H2 CO3)+c(CO32-),故C错误;
D、相同条件下,pH=5的溶液c(H+)=10-5mol/L; c(OH-)=10-9mol/L; OH-全部为水电离出来的,均相同,c(H+):①=②=③,故D错误;
故选A.
点评:本题考查了离子反应、电离方程式、离子浓度大小判断,影响水电离的因素分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
某同学弄清氨的喷泉实验原理后有了一个创新设计:如果改换一下烧瓶内的气体和胶头滴管与烧杯中的液体,也能做成喷泉实验.那么下列各组中的气体和液体不符合该学生设计的一组是( )
| A、SO2和NaOH溶液 |
| B、CO2和NaOH溶液 |
| C、Cl2和饱和食盐水 |
| D、Cl2和NaOH溶液 |
下列各组离子中,能在溶液中大量共存的是( )
| A、H+、Ca2+、Cl-、CO32- |
| B、I-、ClO-、K+、H+ |
| C、Na+、Fe3+、SO42-、OH- |
| D、Na+、Cu2+、Cl-、SO42- |
在AgNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后,有少量金属析出,过滤,向滤液中滴加盐酸,有白色沉淀生成,该沉淀不溶于稀硝酸,则析出的金属是( )
| A、Cu和 Ag |
| B、Ag |
| C、Cu |
| D、Cu 和 Fe |
下列气体不会造成空气污染的是( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、SO2 |
设nA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4L氯气与过量的铁完全反应,转移电子数为2nA |
| B、42gC3H6中含有的共用电子对数目为8nA |
| C、加热下,1molH2和1molI2混合反应生成的气体分子数为2nA |
| D、0.01mol?L-1的KAl(SO4)2溶液中含有0.02nA个SO42- |

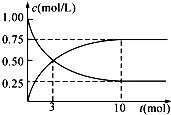 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.