题目内容
15.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )| A. | CO2和H2O | B. | CCl4和KCl | C. | NaCl和HCl | D. | SO2和SiO2 |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键.
解答 解:A、CO2和H2O都是只含共价键的分子晶体,故A正确;
B、CCl4是含共价键的分子晶体,KCl是含离子键的离子晶体,故B错误;
C、NaCl是离子晶体,NaCl中只含离子键,固体HCl分子晶体,HCl中只含共价键,故C错误;
D、SO2是含共价键的分子晶体,SiO2是含共价键的原子晶体,故D错误;
故选:A.
点评 本题考察了化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键.

练习册系列答案
相关题目
5.2016年里约奥运火炬由再生铝和树脂制造而成,燃料是丙烷,充分突出环保理念.下列说法中正确的是( )
| A. | 单质铝不能与烧碱溶液反应 | |
| B. | 丙烷中三个碳原子处于同一直线上 | |
| C. | 丙烷燃烧为放热反应,故C3H8具有的总能量大于CO2和H2O所具有的总能量 | |
| D. | 丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料 |
6.某温度下,在一固定容积的容器中进行反应:SO3(g)+NO(g)?NO2 (g)+SO2(g),下列情况一定能说明已经达到化学反应限度的是( )
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和 NO2(g)的生成速率相同 | D. | SO3 (g)和 NO(g)的浓度比为 1:1 |
3.两种气态烃的混合气体共0.5mol,在空气中完全燃烧生成标准状况下CO216.8L和18g水,关于该混合气体的说法正确的是( )
①一定有CH4②一定有C2H4③一定没有C2H6④可能有C2H4⑤可能有C3H4.
①一定有CH4②一定有C2H4③一定没有C2H6④可能有C2H4⑤可能有C3H4.
| A. | ①③④ | B. | ①②④⑤ | C. | ①④⑤ | D. | ①③④⑤ |
10.可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A. | 氯化铁溶液 饱和溴水 | B. | 碳酸钠溶液 饱和溴水 | ||
| C. | 酸性高锰酸钾溶液 饱和溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
20.在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A. | VA═0.5mol L-1S-1 | B. | VB═0.3mol L-1S-1 | ||
| C. | VC═4.8mol L-1min-1 | D. | VD═1mol L-1S-1 |
7.为了尽可能准确量取50mL某溶液,应选用的仪器是( )
| A. | 50mL烧杯 | B. | 25mL量筒 | C. | 100mL容量瓶 | D. | 500mL量杯 |
12.海水资源的利用具有广阔前景.海水中主要离子的含量如下表所示.
利用海水可以提取溴和镁,提取过程如下.
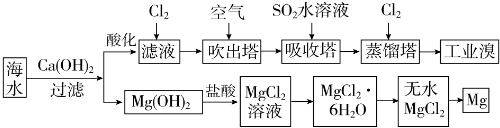
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).