题目内容
1.以溴乙烷为原料制备乙二醇,下列方案合理的是( )| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$\stackrel{浓硫酸、170℃}{→}$CH2═CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| B. | CH3CH2Br$\stackrel{Br}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| C. | CH3CH2Br $\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 |
分析 CH3CH2Br在氢氧化钠水溶液、加热条件下发生取代反应生成CH3CH2OH,CH3CH2OH在浓硫酸、加热条件下发生消去反应生成CH2=CH2,乙烯与溴发生加成反应生成1,2-二溴乙烷,1-2二溴乙烷在氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇.
解答 解:A.以溴乙烷为原料制备乙二醇步骤为:CH3CH2Br在氢氧化钠水溶液、加热条件下发生取代反应生成CH3CH2OH,CH3CH2Br+NaOCH3CH2OH+NaBr,CH3CH2OH在浓硫酸、加热条件下发生消去反应生成CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,生成CH2=CH2,乙烯与溴发生加成反应CH2=CH2+Br2→CH2BrCH2Br,生成1,2-二溴乙烷,1-2二溴乙烷在氢氧化钠水溶液、加热条件下发生水解反应CH2BrCH2Br+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaBr生成乙二醇,故A正确;
B.溴乙烷与溴原子不反应,故B错误;
C.CH3CH2Br在氢氧化钠醇溶液、加热条件下发生消去生成乙烯,乙烯与溴化氢生成溴乙烷,该步骤为重复步骤,且溴乙烷与溴单质反应不能主要生成1,2-二溴乙烷,故C错误;
D.CH3CH2Br在氢氧化钠醇溶液、加热条件下发生消去生成乙烯,乙烯与溴化氢生成溴乙烷,不生成CH2BrCH2Br,故D错误;
故选A.
点评 本题考查有机物的结构和性质、有机物的合成等,明确常见的反应类型、物质结构与性质的关系,掌握官能团的性质与转化是关键,题目难度中等.

练习册系列答案
相关题目
9.下表列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是②(填写编号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)PCl3、CCl4.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期ⅥA族.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是②(填写编号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)PCl3、CCl4.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期ⅥA族.
9.某科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)═2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )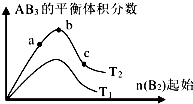

| A. | 反应速率a>b>c | |
| B. | 达到平衡时 A2的转化率大小为:b>a>c | |
| C. | 若T2>T1,则正反应一定是吸热反应 | |
| D. | 达到平衡时,AB3的物质的量大小为:b>c>a |
16.下列叙述正确的是( )
| A. | 常温常压下,4.6gNO2气体约含有1.81×1023个原子 | |
| B. | 在标准状况下,80gSO3所占的体积约为22.4L | |
| C. | 常温下,IL0.lmol/L磷酸溶液含有0.1NA个H+ | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
6.化学与社会发展以及人们生活质量的提高有密切关系.下列的叙述不正确的是( )
| A. | 在1个标准大气压下,水只有在100℃时才能蒸发 | |
| B. | 用13C或14C示踪原子可以进行幽门螺旋杆菌的检测 | |
| C. | 用NaHCO3溶液可以洗去蔬菜、水果等的残留农药 | |
| D. | 使用含钙、镁离子浓度较大的地下水洗衣服,肥皂去污能力会减弱 |
10. 在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )
在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )
 在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )
在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )| A. | 分度盘的左边 | B. | 分度盘的中间 | ||
| C. | 分度盘的右边 | D. | 三种情况都有可能 |
11.仪器名称为“分液漏斗”的是( )
| A. |  | B. |  | C. |  | D. |  |