题目内容
19.在下列各溶液中,离子一定能大量共存的是( )| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液::K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
分析 A.强碱性溶液含大量的氢氧根离子;
B.滴加石蕊试液显红色的溶液,显酸性;
C.离子之间结合生成沉淀;
D.MnO4-为紫色.
解答 解:A.强碱性溶液含大量的氢氧根离子,与Mg2+结合生成沉淀,不能共存,故A错误;
B.滴加石蕊试液显红色的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.CO32-、Ca2+结合生成沉淀,不能大量共存,故C错误;
D.MnO4-为紫色,与无色不符,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 阳离子只具有氧化性,阴离子只具有还原性 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 物质在反应中失去电子数越多,其还原性越强 |
4.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 17gOH-中含有的电子数为10NA | |
| B. | 标准状况下,lmol CCl4的体积约为22.4L | |
| C. | 1mol/LNa2CO3溶液中含有的Na+离子数为2NA | |
| D. | 常温常压下,1NA个CO2分子占有的体积为22.4L |
14.钴(Co)及其化合物在工业上有广泛应用,为从某工业废料中回收钴,设计了如下流程(废料中含有Al、Li、Co2O3和Fe2O3等物质).
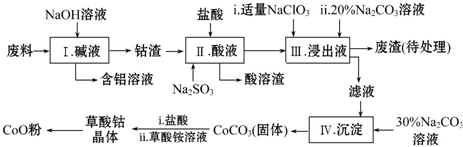
已知:部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.[M(CoC2O4•2H2O)=183g•mol-1]
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.
15.有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是( )
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe $\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4 溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3 $\stackrel{H_{2}O}{→}$H2SO4.
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe $\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4 溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3 $\stackrel{H_{2}O}{→}$H2SO4.
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- | |
| D. | 以上说法都不正确 |
 ;
; .
.