题目内容
18.根据表中信息判断,下列选项不正确的是( )| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:1 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+ |
分析 A.反应中Mn元素化合价降低,则KMnO4为氧化剂,H2O2为还原剂,元素被氧化生成氧气;
B.由于还原性Fe2+>Br-,故氯气先氧化Fe2+,发生反应:3Cl2+6FeBr2=2FeCl3+4FeBr3,则Cl2与 FeBr2的物质的量之比≤1:2时产物为FeCl3、FeBr3;
C.反应中Mn元素化合价降低,KMnO4作氧化剂,氯气为氧化产物,则反应物中含有Cl-,根据氯元素化合价变化计算转移电子;
D.氧化剂氧化性强于氧化产物氧化性.
解答 解:A.反应中Mn元素化合价降低,则KMnO4为氧化剂,H2O2为还原剂,H2O2被氧化生成氧气,由原子守恒可知,还有水生成,故A正确;
B.由于还原性Fe2+>Br-,故氯气先氧化Fe2+,发生反应:3Cl2+6FeBr2=2FeCl3+4FeBr3,则Cl2与 FeBr2的物质的量之比≤1:2时产物为FeCl3、FeBr3,若Cl2与 FeBr2的物质的量之比为1:1,部分溴离子比氧化,故B错误;
C.反应中Mn元素化合价降低,KMnO4作氧化剂,氯气为氧化产物,则反应物中含有Cl-,生成1mol Cl2,转移电子为1mol×2=2mol,故C正确;
D.反应②中氯气可以氧化溴离子为溴单质,氧化亚铁离子为铁离子,溴单质可以氧化亚铁离子为铁离子,故氧化性Cl2>Br2>Fe3+,反应③KMnO4为氧化剂,Cl2为氧化产物,故氧化性MnO4->Cl2,则氧化性MnO4->Cl2>Br2>Fe3+,故D正确,
故选:B.
点评 本题考查氧化还原反应计算、氧化性强弱比较、氧化还原反应方程式配平等,注意氯气与溴化亚铁反应先后顺序问题,难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
9.下列说法正确的是( )
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| C. | 在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3 | |
| D. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L |
6.m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
| A. | 沉淀中OH-的质量为(n-m)g | |
| B. | 恰好溶解后溶液中的NO$\frac{-}{3}$的物质的量为aVmol | |
| C. | 反应过程中转移的电子的物质的量为$\frac{n-m}{17}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{aV}{1000}$)mol |
10.对Na2O和Na2O2的叙述正确的是( )
| A. | Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 | |
| B. | Na2O与Na2O2不可以相互转化 | |
| C. | 取一块金属钠放在燃烧匙里加热,金属先熔化,燃烧时火焰呈黄色,生成淡黄色固体 | |
| D. | 在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
7.下列物质的制备方法正确的是( )
| A. | 蛋白质水解可制得葡萄糖 | |
| B. | 用硅酸钠溶液与稀盐酸反应可制得硅酸 | |
| C. | 二氧化锰和稀盐酸混合加热可制得氯气 | |
| D. | 将饱和氯化铁溶液加热至沸腾可制得氢氧化铁胶体 |
8.已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:

ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
(2)已知反应一是放热反应,画出能量关系示意图2.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.

ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;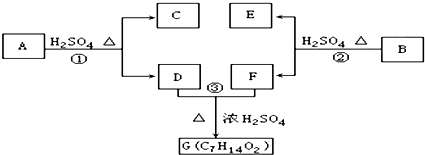
 ;
; ;
; ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+