题目内容
7.下列物质的制备方法正确的是( )| A. | 蛋白质水解可制得葡萄糖 | |
| B. | 用硅酸钠溶液与稀盐酸反应可制得硅酸 | |
| C. | 二氧化锰和稀盐酸混合加热可制得氯气 | |
| D. | 将饱和氯化铁溶液加热至沸腾可制得氢氧化铁胶体 |
分析 A.蛋白质是由氨基酸构成的;
B.盐酸酸性强于硅酸,可以使用硅酸钠溶液与盐酸反应制取硅酸;
C.浓盐酸和二氧化锰混合加热制氯气;
D.将氯化铁饱和溶液逐滴加入沸水中,制得氢氧化铁胶体溶液.
解答 解:A.蛋白质水解得到氨基酸,故A错误;
B.根据强酸制取弱酸原理,可以使用硅酸钠与盐酸制取硅酸,故B正确;
C.浓盐酸和二氧化锰混合加热制氯气,与稀盐酸不反应,故C错误;
D.将饱和氯化铁溶液加热至沸腾得不到氢氧化铁胶体溶液,故D错误.
故选B.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,题目难度不大.

练习册系列答案
相关题目
17.已知25℃下碳酸的电离常数K1=4.4×10-7,K2=4.7×10-11.下列有关碳酸溶液中各微粒浓度关系的说法正确的是( )
| A. | c(H+)═c(OH-)+c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) | B. | c(H+)>c(HCO${\;}_{3}^{-}$)>c(H2CO3) | ||
| C. | c(H2CO3)═2c(H+)+c(CO${\;}_{3}^{2-}$) | D. | c(H+)═c(OH-)+c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$) |
18.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:1 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+ |
15.下列说法正确的是( )
| A. | 用广泛pH试纸测氯水的pH=4 | |
| B. | 欲配制1L,1mol/L的NaCl溶液,可将58.5gNaCl溶于1 L水中 | |
| C. | 配制溶液定容时,仰视容量瓶刻度会使所配溶液浓度偏低 | |
| D. | 用瓷坩埚加热熔化氢氧化钠固体 |
2.已知2Fe+3Br2═2FeBr3、2Fe3++2I-═2Fe2++I2、4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+现将Fe(NO3)2溶液分别滴入到以下溶液中①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+转变为Fe3+的是( )
| A. | ①②③④ | B. | 只有②③ | C. | ①②③ | D. | ②③④ |
12.如表内容与结论不相对应的是( )
| 内容 | 结论 | |
| A | 一个反应的△H>0,△S>0 | 反应一定不能自发进行 |
| B | 硝酸铵溶于水可自发进行 | 因为该反应的△S>0 |
| C | H2O(g)变成H2O(l) | △S<0 |
| D | H2(g)+F2(g)═2HF(g)的△H=-271kJ•mol-1,△S=+8J•mol-1•K-1 | 反应在任意温度下都能自发进行 |
| A. | A | B. | B | C. | C | D. | D |
16.下列反应的离子方程式正确的是( )
| A. | 用小苏打治疗胃酸(主要成分为盐酸)过多:HCO3-+H+=CO2↑+H2O | |
| B. | 氢氧化钡溶液和硫酸溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 澄清的石灰水跟稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
17.绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.以下反应最符合这一要求的是( )
| A. | 铜和浓硝酸反应制硝酸铜 | |
| B. | 用铜作催化剂将乙醇氧化为乙醛 | |
| C. | 乙烯聚合为聚乙烯 | |
| D. | 光照条件下甲烷与氯气反应制一氯甲烷 |
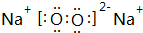 ;
; ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.