题目内容
8.已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.
分析 甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B,由转化关系可知,反应一为合成氨,甲、乙分别为氮气、氢气中一种,方法一是氯气与氨气反应生成氯化铵与氮气,丙为氯气、B为NH4Cl.
(1)B为NH4Cl,含有H元素处于第一周期IA族,N元素处于第二周期VA族,Cl元素处于第三周期ⅦA族;
(2)反应一是放热反应,则反应物总能量高于生成物总能量;
(3)有气体参与反应,增大压强,反应速率加快;
(4)方法一是氯气与氨气反应生成氯化铵与氮气;
(5)方法二:甲和丙反应的产物与A反应即可,则甲为氢气、乙为氮气,甲和丙反应的产物为HCl,HCl与氨气反应生成NH4Cl,方法二的原子利用率100%,零排放.
解答 解:甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B,由转化关系可知,反应一为合成氨,甲、乙分别为氮气、氢气中一种,方法一是氯气与氨气反应生成氯化铵与氮气,丙为氯气、B为NH4Cl.
(1)B为NH4Cl,含有H元素处于第一周期IA族,N元素处于第二周期VA族,Cl元素处于第三周期ⅦA族,如图所示:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | H | |||||||
| 2 | N | |||||||
| 3 | Cl |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | H | |||||||
| 2 | N | |||||||
| 3 | Cl |
(2)反应一是放热反应,则反应物总能量高于生成物总能量,能量关系示意图为:
 ,
,故答案为:
 ;
;(3)适当升高温度、选用恰当的催化剂、增大某一反应物的浓度可以加快反应速率,由于有气体参与反应,增大压强,反应速率加快,
故答案为:增大压强;
(4)方法一是氯气与氨气反应生成氯化铵与氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
故答案为:3Cl2+8NH3=N2+6NH4Cl;
(5)方法二:甲和丙反应的产物与A反应即可,则甲为氢气、乙为氮气,甲和丙反应的产物为HCl,HCl与氨气反应生成NH4Cl,方法二的原子利用率100%,零排放,符合绿色化学理念,方法二更好,
故答案为:方法二;方法二的原子利用率100%,零排放,符合绿色化学理念.
点评 本题考查无机物推断,涉及元素周期表、化学反应速率影响因素、化学反应速率转化能力变化、绿色化学等,需要学生熟练掌握中学常见化学工业,难度中等.

练习册系列答案
相关题目
18.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:1 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+ |
16.下列反应的离子方程式正确的是( )
| A. | 用小苏打治疗胃酸(主要成分为盐酸)过多:HCO3-+H+=CO2↑+H2O | |
| B. | 氢氧化钡溶液和硫酸溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 澄清的石灰水跟稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
3.下列说法正确的是( )
| A. | 在化学反应中,原子重新组合时伴随着能量的变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
13.下列离子方程式书写正确的是( )
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓ |
17.绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物.以下反应最符合这一要求的是( )
| A. | 铜和浓硝酸反应制硝酸铜 | |
| B. | 用铜作催化剂将乙醇氧化为乙醛 | |
| C. | 乙烯聚合为聚乙烯 | |
| D. | 光照条件下甲烷与氯气反应制一氯甲烷 |
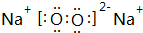 ;
; ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形. 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为: