题目内容
13. 如表为元素周期表前四周期,其中的字母代表相应的元素.
如表为元素周期表前四周期,其中的字母代表相应的元素.| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | k | ||||||||||||||
| h | I | j |
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为Al<Mg<O<N.(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,其中1mol苯甲醛分子(如图1)中含有σ键的数目为14NA此有机物中C原子的杂化类型为sp2.
(4)元素d与e形成的化合物常用于制作耐火材料.
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为NO2-.
(6)已知j的晶胞结构如图2所示,又知j的密度为9.00g/cm3,则晶胞边长为$\root{3}{\frac{4×64}{9{N}_{A}}}$cm;jkd4常作电镀液,其中kd42-的空间构型是正四面体.k原子的杂化轨道类型是sp3.
分析 由前四周期元素位置可知,a为H,b为C,c为N,d为O,e为Mg,f为Al,g为P,k为S,h为Fe,I为Co,j为Cu.
(1)h为Fe,原子外围电子排布为3d64s2,原子失去4s能级2个电子形成Fe2+;
(2)Mg元素3s能级为全满稳定状态,N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大;
(3)苯环不含碳碳双键,单键为σ键,双键含有1个σ键,苯甲醛分子含有14个σ键;苯环上碳原子、醛基中形成3个σ键,没有孤电子对,杂化轨道数目为3;
(4)元素d与e形成的化合物为MgO,常用于制作耐火材料;
(5)原子总数相等、价电子总数相等微粒互为电子;
表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为
(6)根据均摊法计算晶胞中Cu原子数目,进而计算晶胞质量,根据V=$\frac{m}{ρ}$计算晶胞体积,进而计算晶胞棱长;
计算SO42-中S原子价层电子对数、孤电子对数,确定其空间构型、S原子杂化方式.
解答 解:由前四周期元素位置可知,a为H,b为C,c为N,d为O,e为Mg,f为Al,g为P,k为S,h为Fe,I为Co,j为Cu.
(1)Fe元素原子外围电子排布为3d64s2,失去4s能级2个电子形成Fe2+,Fe2+基态电子排布式为3d6,
故答案为:3d6;
(2)Mg元素3s能级为全满稳定状态,N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故第一电离能:Al<Mg<O<N,
故答案为:Al<Mg<O<N;
(3)苯环不含碳碳双键,单键为σ键,双键含有1个σ键,苯甲醛分子含有14个σ键,1mol苯甲醛含有σ键的数目为14NA;苯环上碳原子、醛基中形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子采取sp2杂化,
故答案为:14NA;sp2;
(4)元素d与e形成的化合物为MgO,熔点很高,常用于制作耐火材料,
故答案为:耐火;
(5)表中有关元素形成的一种离子和单质O3互为等电子体,则该离子的化学式为NO2-,
故答案为:NO2-;
(6)晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{4×64}{{N}_{A}}$g,晶胞体积=$\frac{\frac{4×64}{{N}_{A}}}{9g/c{m}^{3}}$=$\frac{4×64}{9{N}_{A}}$cm3,晶胞棱长=$\root{3}{\frac{4×64}{9{N}_{A}}}$cm;
SO42-中S原子价层电子对数=4+$\frac{6+2-2×4}{2}$=4、孤电子对数为0,其空间构型为正四面体,S原子杂化方式为sp3杂化,
故答案为:$\root{3}{\frac{4×64}{9{N}_{A}}}$cm;正四面体;sp3.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、化学键、等电子体、晶胞计算、杂化方式与空间构型判断等,注意掌握同周期元素第一电离能异常情况,难度中等.

| A. | 将含0.001 mol FeCl3的溶液全部滴到沸水中,可形成0.001 mol Fe(OH)3胶体粒子 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1 nm~100 nm之间的微粒称为胶体 |
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 加碘食盐中加入的I2有利于防止地方缺碘病 | |
| C. | 二氧化硫有漂白性,常用作棉、麻、纸张的漂白 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:(1)如果将4mol NH3 和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为80%.
4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ•mol-1(a>0)
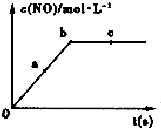
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是v(a正)>v(b逆)=v(c正).
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如表:
| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
②第2min 时改变了条件,改变的条件可能是D(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”、“不移动”).
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O.
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kj•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kj•mol-1
则1mol 甲烷直接将NO2 还原为N2的焓变为△H=-867kJ•mol-1.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
 .
.(5)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-; 第三步Cl2+2Br-=2Cl-+Br2.
(1)下列叙述正确的是AD
A.HCHO与水分子之间能形成氢键
B.HCHO和CO2分子中的中心原子均采用SP2杂化
C.苯分子中含有6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点比二氧化硅晶体的低
(2)Mn和Fe部分电力能数据如表:
| 元素 | Mn | Fe | |
| 电离能/mol | I1 | 717 | 758 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)铁原子核外有26种运动状态不同的电子.
(4)根据元素电子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区
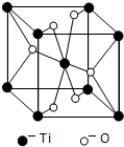
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为TiO2
(6)电镀厂排放的废水中常含有剧毒的CN-离子.可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O
②与CNO-互为等电子体微粒的化学式为CO2、N2O、SCN-等(写一种即可)
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,写出氰酸的结构式:N≡C-O-H.
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.(2)原子半径③>④,金属性③>④,(填“>”或“<”)
(3)②和⑦形成的化合物中,能使品红溶液腿色的是SO2(填化学式),它对环境的主要危害是形成酸雨,⑦、⑧元素形成的氢化物热稳定性较强的是HCl(填化学式).
(4)写出③与水反应的化学方程式2Na+2H2O═H2↑+2NaOH.
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |
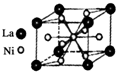 目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.
目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.