题目内容
15.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出).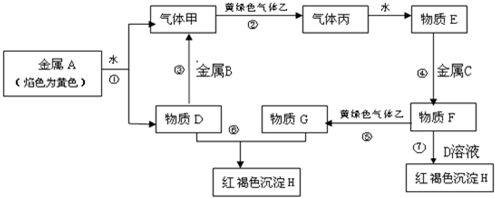
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:ANa、FFeCl2.
(2)说出黄绿色气体乙的一种用途自来水消毒或制造盐酸.
(3)区别E、F两种溶液最简单的方法是观察两种溶液颜色,实验室检验G中所含的金属离子时,常在G的溶液中加入硫氰化钾溶液或氢氧化钠溶液溶液.
(4)反应①的离子方程式为2Na+2H2O=2Na++2OH-+H2↑.
(5)反应⑦的化学方程式为FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,FeCl2与氢氧化钠在空气中生成氢氧化铁,符合各物质的转化关系,以此解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,H为红褐色沉淀,为Fe(OH)3;由反应①Na→气体甲+D,考虑Na与水的反应,故甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C为Fe,F为FeCl2,G为FeCl3,FeCl2与氢氧化钠在空气中生成氢氧化铁,
(1)由以上分析可知A为Na,F为FeCl2,故答案为:Na;FeCl2;
(2)氯气具有强氧化性,可用于杀菌消毒,也可制备盐酸,故答案为:自来水消毒或制造盐酸;
(3)氯化铁、盐酸溶液的颜色不同,可用氢氧化钠反应,可也用KSCN溶液鉴别,
故答案为:观察两种溶液颜色;硫氰化钾溶液或氢氧化钠溶液;
(4)钠和水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(5)反应⑦为FeCl2与氢氧化钠在空气中生成氢氧化铁,反应的化学方程式为FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,为高频考点,把握红褐色沉淀、铝热反应、Fe和Al的化合物性质为解答的关键,侧重分析、推断及应用能力的考查,综合性较强,题目难度中等.

| A. |  | B. | HCHO | ||
| C. |  | D. |  |
| A. | 实验室利用石灰石与稀盐酸制取CO2:CO32-+2H+=CO2↑+H2O | |
| B. | 氯气与H2O的反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | Ba(OH)2溶液与稀H2SO4混合:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化钠与盐酸反应:Na2O+2H+=2Na++H2O |
| A. | 氯气与水发生反应,氯气在反应中减少1mol,溶液中生成的HClO分子数恰好为NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 100 mL pH=2的新制氯水中:N(OH-)+2N(ClO-)+N(HClO)=0.001 NA | |
| D. | 1.6 g CH4含有共用电子对的数目为0.5NA |
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
| A. | 葡萄糖 | B. | 蔗糖 | C. | 乙酸乙酯 | D. | 淀粉 |
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 | |
| C. | 稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 | |
| D. | 浓硫酸与铜片加热反应,既表现了酸性,又表现出强氧化性 |
(1)用如图装置探究气体产物为CO和CO2的混合气体.
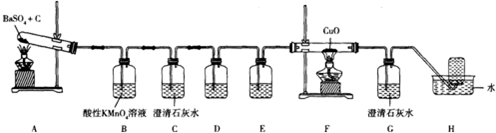
①装置B的作用是排除SO2的干扰.
②装置C的作用是检验CO2.
③装置D中盛放的药品为NaOH溶液,装置E中盛放的药品为浓硫酸.
④能证明有CO生成的现象是装置F中黑色的氧化铜变为红色铜,且G中澄清石灰水变浑浊.
(2)探究固体产物
[查阅资料]硫酸钡与焦炭反应的固体产物可能是硫化钡或亚硫酸钡.硫化钡微溶于水,亚硫酸钡难溶于水,且硫化钡和亚硫酸钡都能与稀盐酸、稀硫酸反应.
[实验方案]取实验后A中残留的固体分别装于2支试管中,设计如下两种方案验证固体产物的成分:
| 方案 | 操作过程及现象 |
| 甲 | 向第l支试管中滴加稀盐酸,将产生的气体通入溴水中,溴水褪色 |
| 乙 | 向第2支试管中滴加稀盐酸,将产生的气体分别通入品红溶液、CuSO4溶液中,品红溶液无变化,CuSO4溶液中产生黑色沉淀 |
①上述实验方案中,能确认固体产物成分的是方案乙(填“甲”或“乙”).
②方案乙中产生黑色沉淀的离子反应方程式为Cu2++H2S=CuS↓+2H+.
(3)经实验测定,硫酸钡与焦炭在加热条件下反应生成气体的平均相对分子质量为$\frac{100}{3}$,固体产物为硫化钡.写出该反应的化学方程式:BaSO4+3C$\frac{\underline{\;\;△\;\;}}{\;}$BaS+2CO↑+CO2↑.