题目内容
7. 为测定Na2S2O3•5H2O产品纯度,准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L?1碘的标准溶液滴定. 反应原理为:2S2O32?+I2=S4O62-+2I?
为测定Na2S2O3•5H2O产品纯度,准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L?1碘的标准溶液滴定. 反应原理为:2S2O32?+I2=S4O62-+2I?(1)滴定至终点时,溶液颜色的变化:溶液由无色变为蓝色.
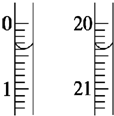
(2)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为20.00mL.
(3)产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)$\frac{0.4M}{W}$%.
分析 (1)反应原理为:2S2O32?+I2=S4O62-+2I?,滴定终点碘过量时,淀粉遇碘变蓝;
(2)由图可知,起始和终点读数分别为0.40mL、20.40mL;
(3)结合2S2O32?+I2=S4O62-+2I?及消耗碘的量计算.
解答 解:(1)反应原理为:2S2O32?+I2=S4O62-+2I?,滴定终点碘过量时,淀粉遇碘变蓝,则滴定结束后,滴定终点时溶液颜色变化为溶液由无色变为蓝色,
故答案为:溶液由无色变为蓝色;
(2)由图可知,起始和终点读数分别为0.40mL、20.40mL,则消耗碘的标准溶液体积为20.40mL-0.40mL=20.00mL,故答案为:20.00;
(3)消耗的碘为0.02L×0.1000mol•L?1=0.002mol,由2S2O32?+I2=S4O62-+2I?可知,n(S2O32-)=2n(I2)=0.004mol,Na2S2O3•5H2O相对分子质量为M,摩尔质量为Mg/mol,则产品的纯度为$\frac{0.004mol×Mg/mol}{Wg}$×100%=$\frac{0.4M}{W}$%,
故答案为:$\frac{0.4M}{W}$%.
点评 本题考查物质含量的测定,为高频考点,把握测定实验原理、滴定管的使用及反应中物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
15.下列有关AgCl的沉淀溶解平衡的说法正确的是( )
| A. | AgCl沉淀生成和溶解同时在不断进行,且速率相等 | |
| B. | AgCl难溶于水,则溶液中没有Ag+和Cl- | |
| C. | 只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成 | |
| D. | 向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
12.下列微粒不影响水的电离平衡的是( )
| A. | CO32- | B. | HCO3- | C. | Ba2+ | D. | NH4+ |
16.分子式为C4H8O2的有机物在酸性条件下可水解生成甲和乙两种有机物,乙在铜的催化作用下能氧化为醛,满足以上条件的酯有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
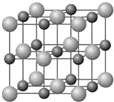 原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.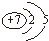 .
.
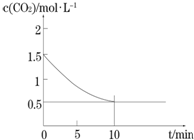 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.