题目内容
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.12g金刚石和石墨的混合物中,碳原子数为NA
B.2Fe2++2H++3H2O2=2Fe3++O2↑+4H2O,则每生成1 mol O2转移电子数为2NA
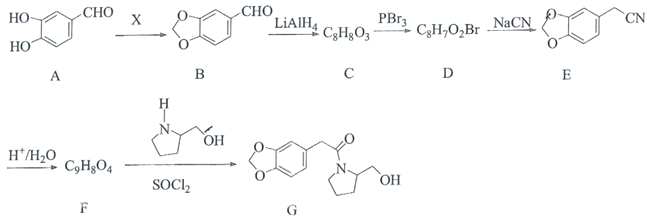
C.已知H3PO2+OH(足量)= ![]() +H2O,说明1 mol H3PO2电离出H+数为NA
+H2O,说明1 mol H3PO2电离出H+数为NA
D.标准状况下,11.2 L乙烷和苯的混合物中C-H数目为 3NA
【答案】A
【解析】
A.金刚石和石墨都由C原子构成,则n(C)=![]() =1mol,即12g金刚石和石墨的混合物中,碳原子数为NA,A正确;
=1mol,即12g金刚石和石墨的混合物中,碳原子数为NA,A正确;
B.反应2Fe2++2H++3H2O2=2Fe3++O2↑+4H2O中,Fe元素化合价从+2升高到+3,升高了2×1,3H2O2中2个-1价的O化合价从-1升高到0,升高了2×1,化合价总升高2×1+2×1=4,3H2O2中4个-1价的O化合价从-1降低到-2,化合价总降低4×1=4,则2Fe2++2H++3H2O2=2Fe3++O2↑+4H2O~4e-,即每生成1 mol O2转移电子数为4NA,B错误;
C.H3PO2+OH(足量)=![]() +H2O,说明H3PO2是一元酸,如果H3PO2是强酸,1 mol H3PO2电离出H+数为NA,如果H3PO2是弱酸,1 mol H3PO2电离出H+数小于NA,C错误;
+H2O,说明H3PO2是一元酸,如果H3PO2是强酸,1 mol H3PO2电离出H+数为NA,如果H3PO2是弱酸,1 mol H3PO2电离出H+数小于NA,C错误;
D.标准状况下,苯不是气体,无法准确计算,D错误。
答案选A。

【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
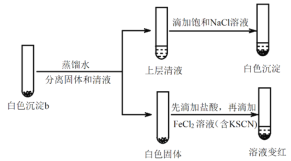
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。