题目内容
SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
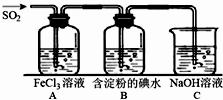
(1)装置A中的现象是 .写出B中发生反应的离子方程式 .
(2)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有 .
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去.
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.上述方案中不合理的是 .
(4)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式 .

(1)装置A中的现象是
(2)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去.
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.上述方案中不合理的是
(4)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式
考点:性质实验方案的设计
专题:
分析:(1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;B中二氧化硫被碘单质氧化生成硫酸和碘化氢;
(2)蒸发用到蒸发皿、酒精灯、石棉网、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,据此进行解答;
(3)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(4)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,据此书写热化学方程式.
(2)蒸发用到蒸发皿、酒精灯、石棉网、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,据此进行解答;
(3)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(4)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,据此书写热化学方程式.
解答:
解:(1)装置A中SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,反应离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,则A中反应的现象为:溶液颜色由黄色逐渐变为浅绿色;
B中二氧化硫被碘单质氧化生成硫酸和碘化氢,离子方程式为:I2+SO2+2H2O=2I-+SO42-+4H+;
故答案为:溶液颜色由黄色逐渐变为浅绿色;I2+SO2+2H2O=2I-+SO42-+4H+;
(2)蒸发用到蒸发皿、酒精灯、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,没有用到烧瓶,所以b错误,故答案为:b;
(3)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;
(4)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,反应的热化学方程式为:
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol.
B中二氧化硫被碘单质氧化生成硫酸和碘化氢,离子方程式为:I2+SO2+2H2O=2I-+SO42-+4H+;
故答案为:溶液颜色由黄色逐渐变为浅绿色;I2+SO2+2H2O=2I-+SO42-+4H+;
(2)蒸发用到蒸发皿、酒精灯、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,没有用到烧瓶,所以b错误,故答案为:b;
(3)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;
(4)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,反应的热化学方程式为:
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol.
点评:本题考查较综合,涉及氧化还原反应的实验,侧重学生分析能力的考查,注意浓硫酸的性质、二氧化硫的检验方法等知识,题目难度中等.

练习册系列答案
相关题目
某固体化合物A不导电,但熔化或溶于水能完全电离.下列关于A的说法中,正确的是( )
| A、A可能是共价化合物 |
| B、A与金刚石的晶体类型相同 |
| C、A中不可能有共价键 |
| D、A溶于水中时一定破坏了A中的离子键 |
第ⅦA元素是重要的成盐元素,其氢化物稳定性最大的是( )
| A、HF | B、HCl |
| C、HBr | D、HI |
烧碱的化学式为( )
| A、NaCl |
| B、NaOH |
| C、NaHCO3 |
| D、Na2SiO3 |
下列过程属于“氮的固定”的是( )
| A、NO2和H2O反应生成HNO3 |
| B、N2和O2经放电生成NO |
| C、通过加压、降温等方法将氮气转变为液态氮 |
| D、NH3被H2SO4硫酸吸收生成(NH4)2SO4 |
只用一种试剂就可鉴别乙酸溶液、葡萄糖溶液、乙醇溶液,这种试剂是( )
| A、NaOH溶液 |
| B、新制Cu(OH)2悬浊液 |
| C、石蕊试液 |
| D、Na2CO3溶液 |
室温时,向20 mL 0.1 mol?L-1NH4HSO4溶液中滴加0.1 mol?L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气 体产生,且混合溶液的体积可看成混合前两溶液的 体积之和),下列说法不正确的是( )


| A、pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B、当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C、当V(NaOH)=30mL时,溶液中 c(SO42-)+c(H+)═c(NH3?H2O)+c(OH-) |
| D、滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol?L-1 |
