题目内容
15.下列实验操作中,正确的是( )| A. |  点燃酒精灯 | B. |  检查气密性 | C. |  读取液体体积 | D. |  加热液体 |
分析 A、不能用燃着的酒精灯来点燃其它的酒精灯;
B、用手握住试管,若气密性良好,则导管有气泡冒出;
C、在读取读数时,应平视;
D、用试管给液体加热时,液体的量不能超过试管的三分之一.
解答 解:A、不能用燃着的酒精灯来点燃其它的酒精灯,否则容易导致酒精洒出,引发火灾,故A错误;
B、用手握住试管,若气密性良好,则试管内的气体热胀冷缩,压强增大,则导管有气泡冒出,故B正确;
C、在读取读数时,应平视,而不能仰视或俯视,故C错误;
D、用试管给液体加热时,液体的量不能超过试管的三分之一,否则容易导致液体溅出伤人,故D错误.
故选B.
点评 本题考查了基本的实验操作和规范,属于基础性题目,强化实验的规范性才能确保实验的安全.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.已知:Pb元素在化合物中有+4和+2两种价态:Pb02受热分解可生成Pb304、Pb0和O2:+4价的Pb能氧化浓盐酸生成Cl2 PbO能与浓盐酸反应但不能将其氧化.现将1.4mol Pb02加热一段时间分解得到O2和固体甲,向甲中加入足量的浓盐酸得到Cl2.反应生成的O2和Cl2的物质的盘之比为2:3,下列说法正确的是 ( )
| A. | 甲可能是Pb304和PbO的混合物 | |
| B. | 整个反应过程中转移电子的总量为2.1mol | |
| C. | 若甲与浓盐酸充分反应,则需要消耗HCl的总量为2.8 mol | |
| D. | 甲中各物质的物质的量之比可能是n(PbO2):n(Pb304):n(PbO)=3:3:2 |
3.对二甲苯 ( PX )是生产矿泉水瓶 (聚对苯二甲酸乙二酯,简称 PET )的必要原料,生产涉及的反应之一如下:5 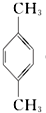 (PX)+12MnO${\;}_{4}^{-}$+36H+→5
(PX)+12MnO${\;}_{4}^{-}$+36H+→5 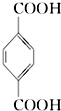 (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )
 (PX)+12MnO${\;}_{4}^{-}$+36H+→5
(PX)+12MnO${\;}_{4}^{-}$+36H+→5  (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过加聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 12N A 个电子 ( NA 为阿伏加德罗常数) |
20.下列关于SiO2和CO2的叙述中不正确的是( )
| A. | 都是共价化合物 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | 都是酸性氧化物,都能与强碱溶液反应 |
7.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
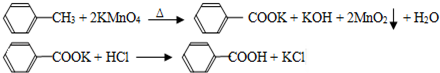
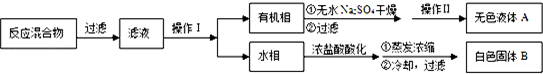
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数为96%(保留二位有效数字).

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶 解,冷却、过滤 | 得到白色晶体和无色溶液 | ----------------- |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
4.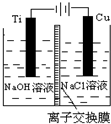 纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
 纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 钛(Ti)电极表面发生氧化反应 | |
| B. | 阳极附近溶液的pH逐渐减小 | |
| C. | 离子交换膜宜采用阴离子交换膜 | |
| D. | 阳极表面总反应式是:2Cu+2OH--2e-═Cu2O+H2O |
5.下列离子方程式中正确的是( )
| A. | 碳酸钙与盐酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亚硫酸钠溶液与稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
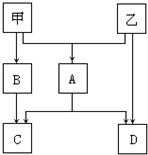 甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.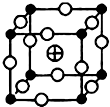 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途. 、
、 、
、 分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.
分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.