题目内容
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)═CO2(g)△H1=-393.5kJ/molCO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol C(s)+
O2(g)═CO(g)△H3=?下列有关说法中不正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ/mol |
| B、二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C、△H3=△H2-△H1=110.5 kJ/mol |
| D、△H3=△H1-△H2=-110.5 kJ/mol |
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:A、由CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol的意义可知CO的燃烧热;
B、CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,为放热反应,逆反应为吸热反应;
C、碳不完全燃烧也是放热反应,△H<0;
D、①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol②CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,根据盖斯定律①-②得C(s)+
O2(g)═CO(g)△H3.
| 1 |
| 2 |
B、CO(g)+
| 1 |
| 2 |
C、碳不完全燃烧也是放热反应,△H<0;
D、①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol②CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:A、CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,CO的燃烧热为283 kJ/mol,故A正确;
B、CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,为放热反应,逆反应为吸热反应,故B正确;
C.碳不完全燃烧也是放热反应,△H<0,故C错误;
D、①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol②CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,根据盖斯定律①-②得C(s)+
O2(g)═CO(g)△H3,所以△H3=△H1-△H2=-110.5 kJ/mol,故D正确;
故选C.
| 1 |
| 2 |
B、CO(g)+
| 1 |
| 2 |
C.碳不完全燃烧也是放热反应,△H<0,故C错误;
D、①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol②CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
故选C.
点评:本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.

练习册系列答案
相关题目
下列化学方程式不能用Ba2++SO42-═BaSO4↓来表示的是( )
| A、Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 |
| B、BaCO3+H2SO4═BaSO4↓+CO2↑+H2O |
| C、Na2SO4+BaCl2═BaSO4↓+2NaCl |
| D、BaCl2+H2SO4═BaSO4↓+2HCl |
阿伏加德罗常数为NAmol-1,下列叙述正确的是( )
| A、1molSO2的质量为64g/mol |
| B、CH4的摩尔质量为16g |
| C、SO2的摩尔质量等于SO2的相对分子质量 |
| D、NA个SO2的质量以克为单位与SO2的相对分子质量在数值上相等 |
已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.下列有关叙述正确的是( )
| A、甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ?mol-1 |
| B、已知:S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
| C、2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1 |
| D、△H>0的化学反应在高温条件下才能自发进行 |
下列物质中,前者属于纯净物,后者属于混合物的是( )
| A、水和冰的混合物,澄清石灰水 |
| B、净化后的空气,氧化镁 |
| C、生锈的铁钉,高锰酸钾充分加热后的剩余固体 |
| D、氯化钾,液氧 |
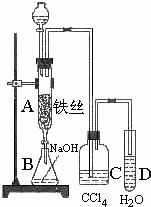 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.