题目内容
已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H= .
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=
考点:用盖斯定律进行有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:由盖斯定律可知2×(2)+(3)-(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),则△H=2△H2+△H3-△H1,带入数据进行计算.
解答:
解:已知(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
(3)2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol
将方程式2×(2)+(3)-(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则△H=2△H2+△H3-△H1=2(-393.5kJ/mol)+(-571.6KJ/mol)-(-870.3KJ/mol)=-488.3kJ/mol,
故答案为:-488.3kJ/mol.
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
(3)2H2(g)+O2(g)=2H2O(l)△H3=-571.6KJ/mol
将方程式2×(2)+(3)-(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则△H=2△H2+△H3-△H1=2(-393.5kJ/mol)+(-571.6KJ/mol)-(-870.3KJ/mol)=-488.3kJ/mol,
故答案为:-488.3kJ/mol.
点评:本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组元素性质的递变情况错误的是( )
| A、P、S、Cl元素最高正价依次升高 |
| B、N、O、F第一电离能依次增大 |
| C、Na、Mg、Al原子最外层电子数依次增多 |
| D、Na、K、Rb电负性逐渐减小 |
用NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A、在一定条件下,催化分解80 g SO3所得混合气体中氧原子数为3NA |
| B、一定条件下,铁与水蒸气反应生成8.96L(已折合成标准状况)H2时,转移的电子数为0.8NA |
| C、将100mL1mol/L AlCl3与100mL3mol/L NaCl溶液混合后,Cl-的个数为0.6NA |
| D、含有非极性键的数目为NA的Na2O2与水充分反应产生标准状况下22.4LO2 |
下列对摩尔(mol)的有关说法中错误的是( )
| A、摩尔是一个单位而非物理量 |
| B、摩尔既能用来计量纯净物,又能用来计量混合物 |
| C、1mol任何气体所含气体的分子数目都相等 |
| D、H2的摩尔质量是2g |
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)═CO2(g)△H1=-393.5kJ/molCO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol C(s)+
O2(g)═CO(g)△H3=?下列有关说法中不正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ/mol |
| B、二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C、△H3=△H2-△H1=110.5 kJ/mol |
| D、△H3=△H1-△H2=-110.5 kJ/mol |
下列有关化学用语表示正确的是( )
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3═Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: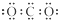 |