题目内容
已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.下列有关叙述正确的是( )
| A、甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ?mol-1 |
| B、已知:S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
| C、2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1 |
| D、△H>0的化学反应在高温条件下才能自发进行 |
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:A、由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
B、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小;
C、H2(g)的燃烧热△H=-285.8kJ?mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1;
D、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发;
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
B、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小;
C、H2(g)的燃烧热△H=-285.8kJ?mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1;
D、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发;
解答:
解:A、由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
即为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1,故A错误;
B、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小,即为△H1>△H2,故B正确;
C、H2(g)的燃烧热△H=-285.8kJ?mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1,注意水的状态,故C错误;
D、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故D错误;
故选B.
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
即为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1,故A错误;
B、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小,即为△H1>△H2,故B正确;
C、H2(g)的燃烧热△H=-285.8kJ?mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ?mol-1,注意水的状态,故C错误;
D、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故D错误;
故选B.
点评:本题考查了热化学方程式及反应热的计算、化学反应进行的方向的判断,难度中等,注意化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,焓变和熵变都不能独立地作为反应自发性的判据,与是否加热无关.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
如图是电解精炼铜装置,其中c、d为铜电极.则下列有关的判断不正确的是( )


| A、c为粗铜板、d为纯铜板 |
| B、电解过程中,SO42-浓度几乎不变 |
| C、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| D、电解过程中,c电极板附近沉积不溶物,d电极板质量增加 |
在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的( )
| A、原子数 | B、分子数 |
| C、质量 | D、密度 |
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)═CO2(g)△H1=-393.5kJ/molCO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol C(s)+
O2(g)═CO(g)△H3=?下列有关说法中不正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ/mol |
| B、二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C、△H3=△H2-△H1=110.5 kJ/mol |
| D、△H3=△H1-△H2=-110.5 kJ/mol |
2014南京青奥会,体操运动员在比赛时为了防滑.常在手掌上涂抹碳酸镁粉末,碳酸镁属于 ( )
| A、酸 | B、碱 | C、盐 | D、氧化物 |
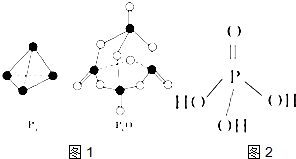 第五主族的磷单质及其化合物在工业上有广泛应用.
第五主族的磷单质及其化合物在工业上有广泛应用. “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.