题目内容
10. 作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用.与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
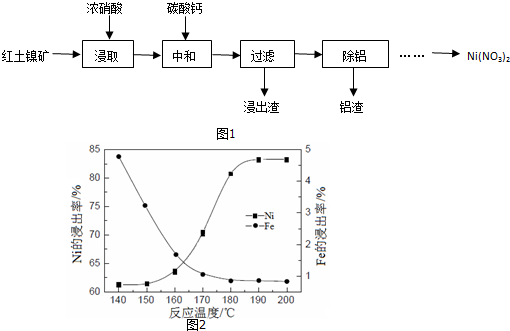
(1)反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示.则pH=8时,ClO2被还原为ClO2-.
(2)亚氯酸根离子(ClO2-)对人体不利.欲在弱碱性条件下将水中的ClO2-转化为Cl-除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2.写出、配平有关化学方程式,并标出电子转移的方向和数目:

(3)以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl→2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4→2ClO2↑+O2↑+Na2SO4+2H2O
①方法一,当有0.2mol电子发生转移时,参与反应的还原剂为0.2 mol.
②方法二:该反应中H2O2a(填序号).
a.发生氧化反应 b.仅做氧化剂 c.既被氧化又被还原 d.既未被氧化也未被还原
③用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是方法二制备的ClO2中不含Cl2.
分析 (1)根据图中的信息:当pH=8时,ClO2被还原为ClO2-的转化率是100%.
(2)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据化合价的升降来判断回答;
(3)①2NaClO3+4HCl→2ClO2↑+Cl2↑+2NaCl+2H2O中4molHCl反应时只有2mol被氧化,转移2mol电子;
②反应二中,H2O2中的O元素的化合价升高;
③两种方法相比较,方法一中生成的气体中含有氯气.
解答 解:(1)根据图中的信息:当pH=8时,ClO2被还原为ClO2-的转化率是100%,
故答案为:ClO2-.
(2)在弱碱性条件下水中的ClO2-转化为Cl-,体现氧化性,该反应体系中的物质NaClO2具有氧化性,FeCl2具有还原性,反应为:NaClO2+NaHCO3+4eCl2+H2O→4e(OH)3+NaCl+CO2↑,该氧化还原反应中,Cl失电子,Fe得到电子,化合价升高值=化合价降低值=转移电子数=4,NaClO2+4FeCl2+8NaHCO3+2H2O=4Fe(OH)3↓+9NaCl+8CO2↑,电子转移表示为: ,
,
故答案为: ;
;
(3)①2NaClO3+4HCl→2ClO2↑+Cl2↑+2NaCl+2H2O中4molHCl反应时只有2mol被氧化,转移2mol电子,所以当有0.2mol电子发生转移时,参与反应的还原剂为为0.2mol;
故答案为:0.2;
②2NaClO3+H2O2+H2SO4→2ClO2↑+O2↑+Na2SO4+2H2O中,H2O2中的O元素的化合价升高,所以H2O2只做还原剂,发生氧化反应;
故答案为:a;
③因方法一制得的ClO2中含有Cl2,Cl2可能生成有机氯代物,则用方法二制备的ClO2更适合用于饮用水的消毒;
故答案为:方法二制备的ClO2中不含Cl2.
点评 本题考查了氧化还原反应、氯的化合物的性质,题目难度中等,注意把握氧化还原反应的有关概念以及电子转移的计算,侧重于考查学生的分析能力和计算能力.

| A. | Ca(HCO3)2(aq)与Ca(OH)2(aq) | B. | Ca(HCO3)2(aq)与NaOH(aq) | ||
| C. | NaHCO3 (aq)与Ca(OH)2(aq) | D. | Mg(HCO3)2(aq)与NaOH (aq) |
| A. | 3g H2 | B. | 11.2L HCl | C. | 1.12L H2O | D. | 3.01×1023个CH4 |
| A. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 | |
| B. | 两种元素组成的分子中一定只有极性键 | |
| C. | 只含共价键的物质,一定是共价化合物 | |
| D. | 氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
| A. | I-131:${\;}_{53}^{77}$I | B. | Cl-的结构示意图: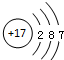 | ||
| C. | 乙炔的结构简式:CHCH | D. | Na2S的电子式: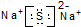 |
| A. | 剩余的5.44g金属为铁 | B. | 剩余5.44g金属为铜 | ||
| C. | 共生成NO气体 0.03mol | D. | 8.08g金属中铁的质量分数为20.8% |
| A. | 阳极发生还原反应 | B. | 铁丝接电源的负极 | ||
| C. | 电子由阴极经溶液流向阳极 | D. | 氯气在阴极区产生 |
| A. | 氧化性:F2<Cl2<Br2<I2 | |
| B. | 次氯酸能杀死病菌,所以氯气可用于自来水的消毒 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |