题目内容
某无色溶液,其中可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-.取该溶液进行有关实验,实验结果如图所示.
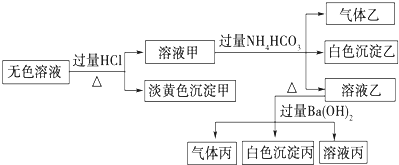
回答下列问题:
(1)沉淀甲的化学式为 .
(2)由溶液甲生成沉淀乙的离子方程式为 .
(3)沉淀丙中一定含有 (填化学式,下同),可能含有 .
(4)综合上述信息,该溶液中肯定存在的离子有 .
(5)该溶液显性 (填酸性、碱性或中性),若要检验其酸碱性,下图操作正确的是 .

请用离子方程式表示显碱性的原因: .

回答下列问题:
(1)沉淀甲的化学式为
(2)由溶液甲生成沉淀乙的离子方程式为
(3)沉淀丙中一定含有
(4)综合上述信息,该溶液中肯定存在的离子有
(5)该溶液显性

请用离子方程式表示显碱性的原因:
考点:常见离子的检验方法
专题:
分析:无色溶液可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-.由实验流程可知,加过量盐酸生成淡黄色沉淀甲为S,则溶液中存在S2-、SO32-,即一定不存在Ba2+;溶液甲中有剩余的HCl,与过量碳酸氢铵反应生成气体乙为二氧化碳,由生成白色沉淀可知,沉淀为氢氧化铝,则应存在AlO2-,转化生成Al3+与HCO3-的相互促进水解生成沉淀和气体;溶液乙中含过量的碳酸氢铵,与氢氧化钡反应生成碳酸钡沉淀和氨气,即丙为BaCO3,气体丙为氨气,溶液丙中含过量的氢氧化钡,由溶液为电中性可知,还含钠离子,而原溶液中SO42-不能确定,以此来解答各小题即可.
解答:
解:无色溶液可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-.由实验流程可知,加过量盐酸生成淡黄色沉淀甲为S,则溶液中存在S2-、SO32-,即一定不存在Ba2+;溶液甲中有剩余的HCl,与过量碳酸氢铵反应生成气体乙为二氧化碳,由生成白色沉淀可知,沉淀为氢氧化铝,则应存在AlO2-,转化生成Al3+与HCO3-的相互促进水解生成沉淀和气体;溶液乙中含过量的碳酸氢铵,与氢氧化钡反应生成碳酸钡沉淀和氨气,即丙为BaCO3,气体丙为氨气,溶液丙中含过量的氢氧化钡,由溶液为电中性可知,还含钠离子,而原溶液中SO42-不能确定,
(1)由上述分析可知,沉淀甲为S,故答案为:S;
(2)溶液甲生成沉淀乙的离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(3)由上述分析可知,硫酸根离子可能存在,则沉淀丙中一定含BaCO3,可能含BaSO4,故答案为:BaCO3;BaSO4;
(4)由上述分析可知,一定存在Na+、AlO2-、S2-、SO32-,故答案为:Na+、AlO2-、S2-、SO32-;
(5)由于此溶液中最后是强碱弱酸盐,故溶液呈碱性,不能把试纸直接插入溶液中检验,故A错误,可以利用洁净的玻璃棒蘸取溶液检验,故B正确,可以利用胶体滴管直接滴在试纸上检验,故D正确,不能直接放在桌面上检验,故C错误;由于S2-、SO32-、AlO2-均可以水解导致溶液呈碱性,以S2-水解为例,离子反应方程式为:S2-+H2O?HS-+OH-,故答案为:碱性;B、D;S2-+H2O?HS-+OH-.
(1)由上述分析可知,沉淀甲为S,故答案为:S;
(2)溶液甲生成沉淀乙的离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(3)由上述分析可知,硫酸根离子可能存在,则沉淀丙中一定含BaCO3,可能含BaSO4,故答案为:BaCO3;BaSO4;
(4)由上述分析可知,一定存在Na+、AlO2-、S2-、SO32-,故答案为:Na+、AlO2-、S2-、SO32-;
(5)由于此溶液中最后是强碱弱酸盐,故溶液呈碱性,不能把试纸直接插入溶液中检验,故A错误,可以利用洁净的玻璃棒蘸取溶液检验,故B正确,可以利用胶体滴管直接滴在试纸上检验,故D正确,不能直接放在桌面上检验,故C错误;由于S2-、SO32-、AlO2-均可以水解导致溶液呈碱性,以S2-水解为例,离子反应方程式为:S2-+H2O?HS-+OH-,故答案为:碱性;B、D;S2-+H2O?HS-+OH-.
点评:本题以实验形式考查无机物的推断,为高频考点,把握离子之间的反应及实验流程中试剂过量为解答的关键,注意利用水解原理及溶液电中性分析解答,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
根据下列有关图象,判断下列说法错误的是( )


| A、由图Ⅰ可知,该反应在T2时达到平衡 |
| B、由Ⅰ图可知,该反应的△H<0 |
| C、图Ⅱ发生反应的化学方程式为2M+6N?3L |
| D、由图Ⅱ可知,若密闭容器中M、N、L的起始浓度依次为0.4mol/L、0.4mol/L、0.2mol/L,保持其他条件不变,达到平衡时L的浓度为0.4mol/L |
已知,有机化合物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如下关系:则下列推断不正确的是( )


| A、B+D→E的化学方程式为:CH3CH2OH+CH3COOH→CH3COOC2H5 |
| B、D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 |
| C、物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 |
| D、鉴别A和甲烷可选择使用酸性高锰酸钾溶液 |
关于溴乙烷与NaOH的乙醇溶液反应说法正确的是( )
| A、该反应是溴乙烷的水解反应 |
| B、往反应后的溶液中直接加入AgNO3溶液检验是否有Br-生成 |
| C、该反应产物中有水、钠盐和不饱和烃 |
| D、生成的气体可直接通入到溴水中检验是否有乙烯生成 |
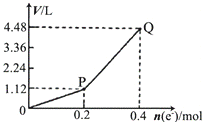 用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol e-时,电解生成的铜为6.4g |
| C、阳极电极反应式为2H2O+4e-=4H++O2↑ |
| D、Q点对应的气体中,H2与O2的体积比为2:1 |
PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,下列有关PM2.5说法不正确的是( )
| A、PM2.5表面积大能吸附大量的有毒、有害物质 |
| B、PM2.5在空气中形成气溶胶 |
| C、实施绿化工程,可以有效地防治PM2.5污染 |
| D、研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
下列变化需要加入还原剂才能实现的转化是( )
| A、Fe2+→Fe3+ |
| B、H2SO4→SO2 |
| C、H2S→SO2 |
| D、HCO3-→CO2 |
 实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)求:
实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)求: