题目内容
根据下列有关图象,判断下列说法错误的是( )


| A、由图Ⅰ可知,该反应在T2时达到平衡 |
| B、由Ⅰ图可知,该反应的△H<0 |
| C、图Ⅱ发生反应的化学方程式为2M+6N?3L |
| D、由图Ⅱ可知,若密闭容器中M、N、L的起始浓度依次为0.4mol/L、0.4mol/L、0.2mol/L,保持其他条件不变,达到平衡时L的浓度为0.4mol/L |
考点:产物的百分含量随浓度、时间的变化曲线,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
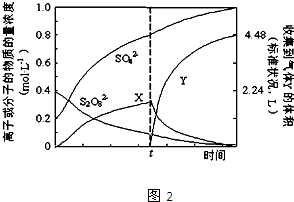
分析:A、反应在T2时,Z的体积分数最小,X的体积分数最大,此时Z不能再减小,即达到平衡;
B、T2时,随温度升高,Z的体积分数增大,向生成Z的方向移动;
C、图Ⅱ,t1时,L、M、N的变化量分别为0.4、0.2、0.6,物质的变化量与化学计量数成正比;
D、根据化学平衡常数不变计算.
B、T2时,随温度升高,Z的体积分数增大,向生成Z的方向移动;
C、图Ⅱ,t1时,L、M、N的变化量分别为0.4、0.2、0.6,物质的变化量与化学计量数成正比;
D、根据化学平衡常数不变计算.
解答:
解:A、反应在T2时,Z的体积分数最小,X的体积分数最大,此时Z不能再减小,经过T2时,Z又增大,即达到平衡,故A正确;
B、T2时,随温度升高,Z的体积分数增大,向生成Z的方向移动,故正反应为放热反应,△H<0,故B正确;
C、图Ⅱ,t1时,L、M、N的变化量分别为0.4、0.2、0.6,物质的变化量与化学计量数成正比,发生反应的化学方程式为M+3N?2L,故C错误;
D、t1时,反应达到平衡,平衡常数K=
=
,则M、N、L的起始浓度依次为0.4mol/L、0.4mol/L、0.2mol/L时,根据三段式
M+3N?2L
起始0.4 0.4 0.2
变化 x 3x 2x
平衡 0.4-x 0.4-3x 0.2+2x
平衡常数K=
=
,
解得x=0.1,平衡时L的浓度为0.2+2x=0.4mol/L,故D正确.
故选:C.
B、T2时,随温度升高,Z的体积分数增大,向生成Z的方向移动,故正反应为放热反应,△H<0,故B正确;
C、图Ⅱ,t1时,L、M、N的变化量分别为0.4、0.2、0.6,物质的变化量与化学计量数成正比,发生反应的化学方程式为M+3N?2L,故C错误;
D、t1时,反应达到平衡,平衡常数K=
| c2(L) |
| c(M)c3(N) |
| 0.42 |
| 0.13×0.3 |
M+3N?2L
起始0.4 0.4 0.2
变化 x 3x 2x
平衡 0.4-x 0.4-3x 0.2+2x
平衡常数K=
| (0.2+2x)2 |
| (0.4-x)×(0.4-3x)3 |
| 0.42 |
| 0.13×0.3 |
解得x=0.1,平衡时L的浓度为0.2+2x=0.4mol/L,故D正确.
故选:C.
点评:本题考查产物含量随温度变化的图象,重在培养学生分析能力和解决问题的能力,难度中等,注意对图象的把握.

练习册系列答案
相关题目
向1L 0.5mol/L的H2SO4溶液中加入10.1g KNO3和12.8g Cu,充分反应后产生的气体在标准状况下的体积为( )
| A、2.24L |
| B、3.36L |
| C、4.48L |
| D、5.60L |
某研究小组采用往一定体积的食醋中滴入已知浓度的NaOH溶液的方法测定食醋中醋酸的浓度.下列说法正确的是( )
| A、滴定时,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点 |
| B、滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量 |
| C、碱式滴定管若滴定前平视读数、滴定后俯视读数,则测定结果偏高 |
| D、锥形瓶用水洗净后未用食醋润洗,则测得的食醋浓度偏低 |
下列有关物质的配置或存放正确的是( )
| A、水晶瓶可存放氢氟酸 |
| B、水玻璃存放在胶塞细口无色玻璃瓶中 |
| C、绿矾溶液可长期存放,不必现用现配 |
| D、氯水存放在胶塞细口棕色玻璃瓶中 |