题目内容
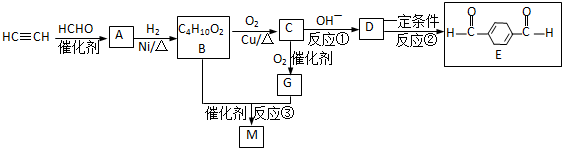
已知:
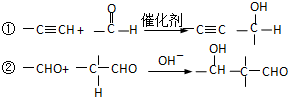
③B为1,4-丁二醇,M是一种聚酯
(1)反应类型:①
(2)结构简式:A
(3)B生成C的化学方程式
(4)检验C是否完全转化为G,所用试剂为
(5)符合以下条件E的同分异构体结构简式
a.有苯环;b.核磁共振氢谱有4个吸收峰;c.能发生水解反应;d.能发生银镜反应.
考点:有机物的推断
专题:有机物的化学性质及推断
分析:根据①可知,HC≡CH与2分子HCHO发生反应生成A: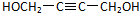 ,该反应属于加成反应;A分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M:
,该反应属于加成反应;A分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M: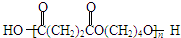 ;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E,根据化合物E的结构简式中含有的C、H、O原子个数,可得其分子式为C8H8O2;
;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E,根据化合物E的结构简式中含有的C、H、O原子个数,可得其分子式为C8H8O2;
根据以上分析进行解答(1)~(4);
(5)根据E的分子式及题中信息要求写出满足条件的结构简式.
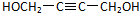 ,该反应属于加成反应;A分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M:
,该反应属于加成反应;A分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M: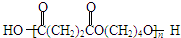 ;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E,根据化合物E的结构简式中含有的C、H、O原子个数,可得其分子式为C8H8O2;
;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E,根据化合物E的结构简式中含有的C、H、O原子个数,可得其分子式为C8H8O2;根据以上分析进行解答(1)~(4);
(5)根据E的分子式及题中信息要求写出满足条件的结构简式.
解答:
解:根据信息①可知,HC≡CH与2分子HCHO反应生成A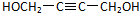 ,A分子中含有碳碳三键,能够与氢气发生加成反应生成有机物BHOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M:
,A分子中含有碳碳三键,能够与氢气发生加成反应生成有机物BHOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M: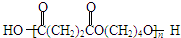 ;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E
;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E
(1)根据题干中的反应原理可知,1个-CHO中的碳氧双键断开1条,碳原子与氧原子上分别加上原子或原子团,符合加成反应的要求,因此属于加成反应;
E分子中含有含有8个C,并且4个双键、1个碳环,其不饱和度为10,则其分子中含有H原子数目为:8×2+2-10=8,所以E的分子式为:C8H8O2,
故答案为:加成反应;C8H8O2;
(2)根据①可知,HC≡CH与2分子HCHO发生反应生成A,则A的结构简式为: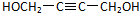 ;
;
C的结构简式为:OHC-CH2-CH2-CHO,1分子C与1分子O2在催化剂作用下,发生氧化反应,生成1,4-丁二酸:HOOC-CH2-CH2-COOH;nmol 1,4-丁二酸与nmol 1,4-丁二醇在催化剂作用下发生缩聚反应,生成1mol聚1,4-丁二酸1,4-丁二酯和(2n-1)molH2O,则E的结构简式为: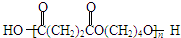 ,
,
故答案为: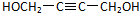 ;
;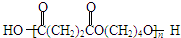 ;
;
(3)A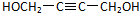 分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成醛C:OHC-CH2-CH2-CHO,则B生成C的化学方程式为:
分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成醛C:OHC-CH2-CH2-CHO,则B生成C的化学方程式为: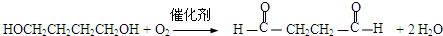 ,
,
故答案为: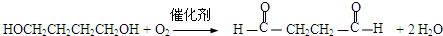 ;
;
(4)C、G的结构简式分别为:OHC-CH2-CH2-CHO、HOOC-CH2-CH2-COOH,检验C是否完全转化为G的关键是否存在醛基,由于醛基能被新制银氨溶液或Cu(OH)2悬浊液氧化,分别出现银镜或砖红色沉淀,则检验试剂为新制银氨溶液或Cu(OH)2悬浊液,
故答案为:银氨溶液(或新制的Cu(OH)2);
(5)E的分子式为C8H8O2,依题意可知其同分异构体含有1个苯环、1个醛基、一个酯基,“核磁共振氢谱有4个吸收峰”则其结构对称,所以苯环上位于对称位置的两个取代基为HCOO-、-CH3,由此可得其结构简式为: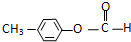 ,
,
故答案为: .
.
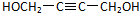 ,A分子中含有碳碳三键,能够与氢气发生加成反应生成有机物BHOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M:
,A分子中含有碳碳三键,能够与氢气发生加成反应生成有机物BHOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M: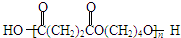 ;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E
;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E(1)根据题干中的反应原理可知,1个-CHO中的碳氧双键断开1条,碳原子与氧原子上分别加上原子或原子团,符合加成反应的要求,因此属于加成反应;
E分子中含有含有8个C,并且4个双键、1个碳环,其不饱和度为10,则其分子中含有H原子数目为:8×2+2-10=8,所以E的分子式为:C8H8O2,
故答案为:加成反应;C8H8O2;
(2)根据①可知,HC≡CH与2分子HCHO发生反应生成A,则A的结构简式为:
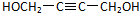 ;
;C的结构简式为:OHC-CH2-CH2-CHO,1分子C与1分子O2在催化剂作用下,发生氧化反应,生成1,4-丁二酸:HOOC-CH2-CH2-COOH;nmol 1,4-丁二酸与nmol 1,4-丁二醇在催化剂作用下发生缩聚反应,生成1mol聚1,4-丁二酸1,4-丁二酯和(2n-1)molH2O,则E的结构简式为:
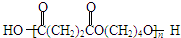 ,
,故答案为:
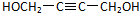 ;
;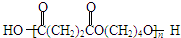 ;
;(3)A
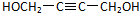 分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成醛C:OHC-CH2-CH2-CHO,则B生成C的化学方程式为:
分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成醛C:OHC-CH2-CH2-CHO,则B生成C的化学方程式为: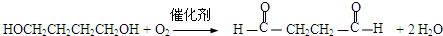 ,
,故答案为:
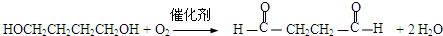 ;
;(4)C、G的结构简式分别为:OHC-CH2-CH2-CHO、HOOC-CH2-CH2-COOH,检验C是否完全转化为G的关键是否存在醛基,由于醛基能被新制银氨溶液或Cu(OH)2悬浊液氧化,分别出现银镜或砖红色沉淀,则检验试剂为新制银氨溶液或Cu(OH)2悬浊液,
故答案为:银氨溶液(或新制的Cu(OH)2);
(5)E的分子式为C8H8O2,依题意可知其同分异构体含有1个苯环、1个醛基、一个酯基,“核磁共振氢谱有4个吸收峰”则其结构对称,所以苯环上位于对称位置的两个取代基为HCOO-、-CH3,由此可得其结构简式为:
 ,
,故答案为:
 .
.
点评:本题考查了有机推断,题目难度较大,可以根据合成路线、已知反应及B的名称、M是聚酯等信息,采用顺推结合逆推的方法综合推断,试题充分考查了学生的分析、理解能力及逻辑推理能力.

练习册系列答案
相关题目
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3-、CO32-、Cl-、NO3-、SO42-中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成.经分析:反应后的溶液中的阴离子的种类没有变化.则下列说法不正确的是( )
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |
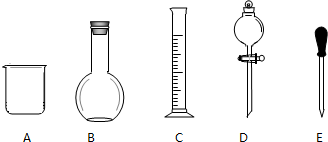 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.