题目内容
(10分,每空2分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中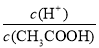 的比值将__________(填“增大”、“减小”或“无法确定”)。
的比值将__________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙) (填“大于”、“小于”或“等于”)。
(3)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。(填“大于”、“小于”或“等于”)。
(4)室温下,现有pH=2的醋酸溶液与PH=12的氨水,等体积混合后,溶液呈中性,则溶液中离子浓度的大小关系:______________
(1)向右、 减小(2).小于 (3)小于 (4)c(CH3COO—)=c(NH4+)>c(H+)=c(OH—)
【解析】
试题分析:(1)弱电解质的浓度越小,弱电解质的电离程度越大;醋酸为弱酸,所以加水醋酸的电离平衡向右移动;加入少量无水醋酸钠固体,醋酸根离子的浓度增大,使醋酸的电离平衡逆向移动,c(H+)减小、c(CH3COOH)增大,所以 的比值将减小;(2)pH=2的盐酸稀释100倍,PH变为4,pH=2的醋酸溶液稀释100倍,PH变为2 ~ 4之间,其pH大小关系为:pH(甲)<pH(乙);(3)pH=2的醋酸溶和等体积pH=12的NaOH溶液,醋酸有剩余,所以反应后溶液呈酸性,故c(Na+)<c(CH3COO-);(4)pH=2的醋酸溶液与PH=12的氨水,混合后溶液中只有c(CH3COO—)、c(NH4+)、c(H+)、c(OH—)四种离子,根据电荷守恒c(CH3COO—)+c(OH—)=c(NH4+)+c(H+),溶液呈中性,c(OH—)=c(H+),故c(CH3COO—)=c(NH4+)>c(H+)=c(OH—)。
的比值将减小;(2)pH=2的盐酸稀释100倍,PH变为4,pH=2的醋酸溶液稀释100倍,PH变为2 ~ 4之间,其pH大小关系为:pH(甲)<pH(乙);(3)pH=2的醋酸溶和等体积pH=12的NaOH溶液,醋酸有剩余,所以反应后溶液呈酸性,故c(Na+)<c(CH3COO-);(4)pH=2的醋酸溶液与PH=12的氨水,混合后溶液中只有c(CH3COO—)、c(NH4+)、c(H+)、c(OH—)四种离子,根据电荷守恒c(CH3COO—)+c(OH—)=c(NH4+)+c(H+),溶液呈中性,c(OH—)=c(H+),故c(CH3COO—)=c(NH4+)>c(H+)=c(OH—)。
考点:本题考查弱电解质的电离。


 值增大
值增大


 ,则该溶液中由水电离出的
,则该溶液中由水电离出的 mol·L-1
mol·L-1