题目内容
3.在固定体积的密闭容器中进行下列反应:A(s)+2B(g)?C(g)+D(g)恒温下,当下列物理量不再变化时,表明上述反应已达平衡的是( )| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | A的物质的量浓度 | D. | 反应速度:VB(正)=VC(逆) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边气体的计量数相等,压强始终不变,故A错误;
B、混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故B正确;
C、A是固体,A的物质的量浓度始终不变,故C错误;
D.反应速率之比等于化学方程式计量数之比为正反应速率之比,VB(正)=2VC(正),当VB(正)=2VC(逆),说明C正逆反应速率相同,所以VB(正)=VC(逆)不能说明反应达到平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡的判断,主要是影响平衡的因素和反应特征的理解应用,“变量不变”是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=+736kJ•mol-1 |
11.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 常温常压下,17 g甲基(-14CH3)所含的中子数为8NA | |
| B. | 0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 L O2混合后气体的分子总数为2NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
18.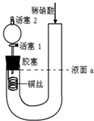 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )
 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )| A. | 在装置左侧稍加热可以加快稀硝酸与铜的反应速率 | |
| B. | 关闭活塞1,加入稀硝酸至液面a处 | |
| C. | 通过关闭或开启活塞1可以控制反应的进行 | |
| D. | 反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
8.开发新材料是现代科技发展的方向之一.下列有关材料的说法正确的是( )
| A. | 氮化硅陶瓷是新型无机非金属材料 | B. | 普通玻璃、有机玻璃都属于硅酸盐 | ||
| C. | 纤维素乙酸酯属于天然高分子材料 | D. | 单晶硅常用于制造光导纤维 |
15.下列离子能在溶液中大量共存的是( )
| A. | Na+、NH4+、CO32-、Br- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Al3+、Ca2+、HCO3-、SO42- | D. | Fe3+、Cu2+、NO3-、OH- |
 一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:
一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象: .
.
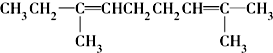 .
. .
.
 ;Y的结构简式为
;Y的结构简式为 .
.