题目内容
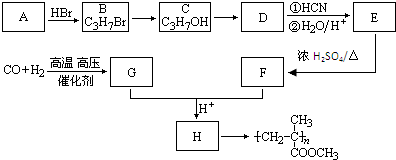
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2?2H2O的质量分数为97.0%-99.9%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe3+是否沉淀完全的实验操作是
(2)酸化操作是加入盐酸,调节溶液的PH约为4.0,其目的有
(3)测定样品中Cl-含量的方法是:
A、取0.75g样品,溶解,移液(含洗涤液),在250mL容量瓶中定容、摇匀;
B、取25.00mL上述待测溶液于锥形瓶中,滴加K2CrO4做指示剂;
C、用0.05mol?L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00mL.
①溶解,移液都用到的玻璃仪器除烧杯外还有 .
②上述测定过程中需用溶液润洗的仪器有 .
③计算上述样品中CaCl2?2H2O的质量分数为 .
④若用上述方法测定的样品中CaCl2?2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 (答其中一点).

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe3+是否沉淀完全的实验操作是
(2)酸化操作是加入盐酸,调节溶液的PH约为4.0,其目的有
(3)测定样品中Cl-含量的方法是:
A、取0.75g样品,溶解,移液(含洗涤液),在250mL容量瓶中定容、摇匀;
B、取25.00mL上述待测溶液于锥形瓶中,滴加K2CrO4做指示剂;
C、用0.05mol?L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00mL.
①溶解,移液都用到的玻璃仪器除烧杯外还有
②上述测定过程中需用溶液润洗的仪器有
③计算上述样品中CaCl2?2H2O的质量分数为
④若用上述方法测定的样品中CaCl2?2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有
考点:探究物质的组成或测量物质的含量,物质的分离、提纯和除杂,制备实验方案的设计
专题:实验题
分析:(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(2)因在除杂过程中加入了Ca(OH)2,故加入盐酸与溶液中的少量Ca(OH)2反应使其转化为CaCl2;(3)①溶解,移液都用到的玻璃仪器除烧杯外还有玻璃棒搅拌,引流;
②上述测定过程中需用溶液润洗的仪器有滴定管;
③根据到达滴定终点生成氯化银的物质的量等于消耗的硝酸银的物质的量这一关系求出消耗硝酸银的物质的量,则n(AgCl)=2n(CaCl2.2H2O)
据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量.注意的是我们是从250mol中取25ml,所以在计算时要注意这一点;
④样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.
(2)因在除杂过程中加入了Ca(OH)2,故加入盐酸与溶液中的少量Ca(OH)2反应使其转化为CaCl2;(3)①溶解,移液都用到的玻璃仪器除烧杯外还有玻璃棒搅拌,引流;
②上述测定过程中需用溶液润洗的仪器有滴定管;
③根据到达滴定终点生成氯化银的物质的量等于消耗的硝酸银的物质的量这一关系求出消耗硝酸银的物质的量,则n(AgCl)=2n(CaCl2.2H2O)
据此可以算出实际上的CaCl2.2H2O的物质的量,进而求出质量.注意的是我们是从250mol中取25ml,所以在计算时要注意这一点;
④样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.
解答:
解:(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,
故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的为将溶液中的少量Ca(OH)2转化为CaCl2;
故答案为:将溶液中的少量Ca(OH)2转化为CaCl2;
(3)①溶解,移液都用到的玻璃仪器除烧杯外还有玻璃棒搅拌,引流;
故答案为:玻璃棒;
②上述测定过程中需用溶液润洗的仪器有酸式滴定管;
故答案为:酸式滴定管;
③样品中n(Cl-)=0.05000mol?L-1×0.0200L×10=0.0100mol,根据n(AgCl)=2n(CaCl2.2H2O),则n(CaCl2.2H2O)=0.00500mol,所以m(CaCl2.2H2O)=0.00500mol×147g/mol=0.735g,则有:
×100%=98.0%,
故答案为:98.0%;
④样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大,
故答案为:样品中存在少量的NaCl或少量的CaCl2.2H2O失水.
故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的为将溶液中的少量Ca(OH)2转化为CaCl2;
故答案为:将溶液中的少量Ca(OH)2转化为CaCl2;
(3)①溶解,移液都用到的玻璃仪器除烧杯外还有玻璃棒搅拌,引流;
故答案为:玻璃棒;
②上述测定过程中需用溶液润洗的仪器有酸式滴定管;
故答案为:酸式滴定管;
③样品中n(Cl-)=0.05000mol?L-1×0.0200L×10=0.0100mol,根据n(AgCl)=2n(CaCl2.2H2O),则n(CaCl2.2H2O)=0.00500mol,所以m(CaCl2.2H2O)=0.00500mol×147g/mol=0.735g,则有:
| 0.735g |
| 0.7500g |
故答案为:98.0%;
④样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大,
故答案为:样品中存在少量的NaCl或少量的CaCl2.2H2O失水.
点评:本题考查混合物中含量的测定,涉及实验的基本操作、实验仪器的选择、实验误差分析、混合物分离及含量测定的计算等,注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,注意有效数字问题,题目综合性较强,难度中等.

练习册系列答案
相关题目
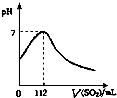 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )| A、0.5 mol?L─1 |
| B、0.05 mol?L─1 |
| C、1 mol?L─1 |
| D、0.1 mol?L─1 |
下列有关化学实验的基本操作正确的是( )
| A、配置浓硫酸的酒精溶液时,要将酒精缓慢注入浓硫酸中,并充分搅拌 |
| B、用pH试纸测量某溶液的酸碱度时,必须先用水润湿pH试纸 |
| C、中和滴定实验中,眼睛要始终注视滴定管中液面的变化 |
| D、实验室做醛的银镜反应时,一般采用水浴加热混合液 |

 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
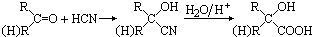 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成: