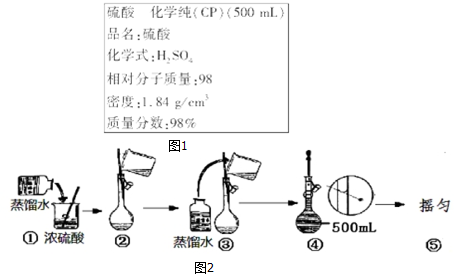
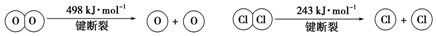题目内容
8.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为2mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加3.4g,则下列有关叙述中正确的是( )| A. | 开始加入合金的质量可能为5.6g | |
| B. | 参加反应的硝酸的物质的量为0.2mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为200mL | |
| D. | 标况下产物NO体积为4.48L |
分析 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加3.4g,则氢氧化镁和氢氧化铜含有氢氧根的质量为3.4,氢氧根的物质的量为$\frac{3.4g}{17g/mol}$=0.2mol,根据电子转移守恒,则镁和铜的总的物质的量为0.1mol,以此来解答.
解答 解:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加3.4g,则氢氧化镁和氢氧化铜含有氢氧根的质量为3.4,氢氧根的物质的量为$\frac{3.4g}{17g/mol}$=0.2mol,根据电子转移守恒,则镁和铜的总的物质的量为0.1mol,
A.镁和铜的总的物质的量为0.1mol,假定全为镁,质量为0.1mol×24g/mol=2.4g,若全为铜,质量为0.1mol×64g/mol=6.4g,所以参加反应的金属的总质量(m)为2.4g<m<6.4g,则开始加入合金的质量可能为5.6g,故A正确;
B.由N原子守恒可知,n(硝酸)=2n(硝酸盐)+n(NO),镁和铜的总的物质的量为0.1mol,则参加反应的硝酸的物质的量为0.2mol+$\frac{0.1mol×(2-0)}{(5-2)}$>0.2mol,故B错误;
C.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.2mol,需要氢氧化钠溶液体积为$\frac{0.2mol}{2mol/L}$=0.1L=100mL,硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故C错误;
D.镁和铜的总的物质的量为0.1mol,根据电子转移守恒可知生成的NO物质的量为$\frac{0.1mol×(2-0)}{3}$,若为标准状况下,生成NO的体积为0.1mol×$\frac{2}{3}$×22.4L/mol=1.49L,故D错误;
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的发反应、电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

| A. | >40% | B. | <40% | C. | =40% | D. | 无法确定 |
| A. | H2 | B. | HCl | C. | O2 | D. | CO2 |
| X | 某单质之一是空气中主要成分,最常见的助燃剂 |
| Y | 其某种核素不含中子 |
| Z | 失去一个电子后,形成Ne原子电子层结构 |
| W | 最外层电子数是次外层电子数的2倍 |
(2)画出下列微粒的结构示意图 Z+,W 原子
 、
、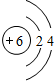 .
.(3)写出两种由上述任意三种元素组成的水溶液呈碱性的物质NaOH、Na2CO3(或NaHCO3).(填化学式)
| A. | 无色溶液中:Na+、Cl-、SO42-、Cu2+ | |
| B. | 滴加紫色石蕊试液显红色的溶液:NH4+、Fe2+、SO42-、NO3- | |
| C. | 滴加酚酞显红色的溶液:K+、Ba2+、Cl-、NO32- | |
| D. | 含有大量HS-的溶液:NH4+、Ca2+、H+、I- |
| A. | 二氧化硫易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |