题目内容
3.现有部分元素的原子结构特点如表:| X | 某单质之一是空气中主要成分,最常见的助燃剂 |
| Y | 其某种核素不含中子 |
| Z | 失去一个电子后,形成Ne原子电子层结构 |
| W | 最外层电子数是次外层电子数的2倍 |
(2)画出下列微粒的结构示意图 Z+,W 原子
 、
、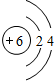 .
.(3)写出两种由上述任意三种元素组成的水溶液呈碱性的物质NaOH、Na2CO3(或NaHCO3).(填化学式)
分析 X其单质之一是空气中主要成分,最常见的助燃剂,X单质为氧气,所以X为O元素;
Y其某种核素不含中子,则Y为H元素;
Z失去一个电子后,形成Ne原子电子层结构,则Z是Na元素;
W最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,则W是C元素;
结合题目分析解答.
解答 解:(1)X其单质之一是空气中主要成分,最常见的助燃剂,X单质为氧气,所以X为O元素,氕不含中子,所以Y是H元素,
故答案为:O;H;
(2)Z+为钠离子,钠离子结构示意图为 ,W是C元素,C原子结构示意图为
,W是C元素,C原子结构示意图为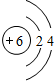 ,
,
故答案为: 、
、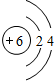 ;
;
(3)两种由上述任意三种元素组成的水溶液呈碱性的物质有NaOH、Na2CO3或NaHCO3,
故答案为:NaOH;Na2CO3(或NaHCO3).
点评 本题考查了原子结构和元素性质,题目难度不大,明确原子结构及元素周期表结构是解本题关键,根据物质的性质及原子结构确定元素,再结合基本理论来分析解答.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 非金属元素组成的化合物中只可能含有共价键 | |
| B. | VIIA族元素气态氢化物的热稳定性从上到下依次减弱 | |
| C. | 第二周期元素原子的半径从左到右依次增大 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
14.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| B. | 铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L | |
| C. | 1 mol•L-1的NH4Cl溶液中的NH4+的数目小于NA | |
| D. | 由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
8.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为2mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加3.4g,则下列有关叙述中正确的是( )
| A. | 开始加入合金的质量可能为5.6g | |
| B. | 参加反应的硝酸的物质的量为0.2mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为200mL | |
| D. | 标况下产物NO体积为4.48L |
15.下列对实验操作及结论的描述正确的是( )
| A. |  用于分离I2和NH4Cl | |
| B. |  用于测定某稀盐酸的物质的量浓度 | |
| C. | 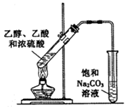 加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯 | |
| D. |  滴入浓硫酸后,KMnO4溶液褪色,说明浓硫酸起到了脱水剂和氧化剂的作用 |
13.下列是一些同学在化学实验操作考试中的做法,你认为正确的是( )
| A. | 胶头滴管伸入量筒内滴加液体 | |
| B. | 用酒精灯的外焰给盛有液体(液体体积约占试管体积的$\frac{1}{4}$)的试管加热 | |
| C. | 称量完药品后,将药匙内剩余的药品放回试剂瓶 | |
| D. | 过滤时漏斗的末端在烧杯的中央 |
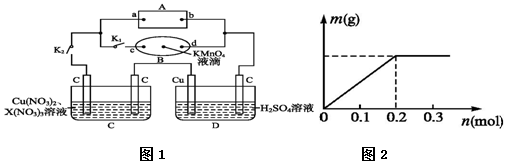
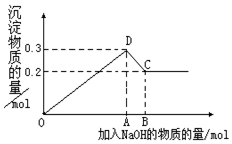 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则: