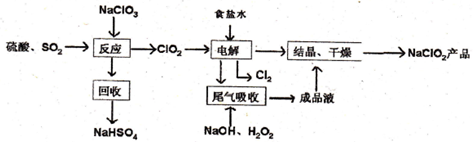
题目内容
8.下列离子方程式书写正确的是( )| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 金溶于王水生成AuCl4-离子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
分析 A.反应生成硫酸钡、水、硫酸钠;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.发生氧化还原反应生成硫酸钠.
解答 解:A.向NaHSO4溶液加入Ba(OH)2溶液至中性的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A错误;
B.氢氧化铁溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.金溶于王水生成AuCl4-离子和NO的离子反应为Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O,故C正确;
D.用NaClO溶液吸收过量的SO2的离子反应为ClO-+SO2+H2O═SO42-+2H++Cl-,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
18.将浓度为0.2rnol•LNH3•H2O溶液加水不断稀释,下列各量增大的是( )
| A. | c(H+) | B. | Kb(NH3•H2O) | ||
| C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$ | D. | c(NH4+) |
17.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 实验室可用排饱和食盐水的方法收集氯气 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 打开汽水瓶,看到有大量的气泡逸出 | |
| D. | Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅 |

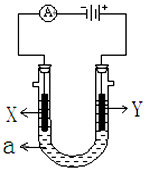 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: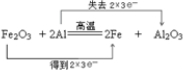 .
.