题目内容
14.有下列四种微粒:①${\;}_{8}^{18}$O、②${\;}_{12}^{24}$Mg、③2311Na、④${\;}_{7}^{14}$N,(1)按原子半径由大到小顺序排列的是③>②>④>①(用序号填空,下同)
(2)微粒中质子数小于中子数的是①③
(3)在化合物中呈现的化合价的数值最多的是④
(4)能形成X3Y2型化合物的是Mg3N2;
写出形成X2Y2型化合物的电子式
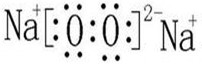 .
.
分析 (1)根据同一周期从左到右元素原子半径逐渐减小以及下一周期元素原子半径比上一周期大;
(2)先根据质量数=质子数+中子数,求出中子数,最后比较大小;
(3)根据O的化合价有:-1、-2、0;Na的化合价有:0、+1;Mg的化合价有:0、+2;N的化合价为:-3、0、+1、+2、+3、+4、+5来解答;
(4)根据X2Y2型化合物的是Na2O2,X3Y2型化合物的是Mg3N2来解答.
解答 解:(1)因同一周期从左到右元素原子半径逐渐减小,所以半径:2311Na>2412Mg,147N>188O; 下一周期元素原子半径比上一周期大,所以2311Na>2412Mg>147N>188O;
故答案为:③>②>④>①;
(2)188O的质子数为8,中子数为10,
2412Mg的质子数为12,中子数为12,
2311Na的质子数为11,中子数为12,
147N的质子数为7,中子数为7,
所以质子数小于中子数的是188O、2311Na;
故答案为:①③;
(3)O的化合价有:-1、-2、0;Na的化合价有:0、+1;Mg的化合价有:0、+2;N的化合价为:-3、0、+1、+2、+3、+4、+5,所以在化合物中呈现的化合价的数值最多的是N;
故答案为:④;
(4)O和Na可以形成Na2O2,电子式: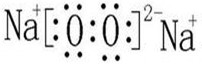 ;Mg和N能形成Mg3N2;
;Mg和N能形成Mg3N2;
故答案为:Mg3N2;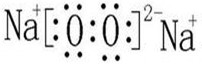 ;
;
点评 本题主要考查了原子半径大小比较、质量数=质子数+中子数,质子数=原子序数以及元素的最高化合价=最外层电子数等,难度不大,在问题(3)中需要注意的是O、F无正价.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知As、Br位于同一周期.下列关系中正确的是( )
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
6.钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域.已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
| A. | 上述钛原子中,中子数不可能为22 | |
| B. | 钛元素在周期表中处于第四周期ⅡB族 | |
| C. | 钛原子的外围电子层排布为3d24s2 | |
| D. | 钛元素位于元素周期表的d区,是过渡元素 |
3.已知25℃时,有关弱酸的电离平衡常数如下表:
则等物质的量浓度的a.CH3COONa,b.NaCN,c.Na2CO3,d.NaHCO3溶液的pH由大到小的顺序是
c>b>d>a(填编号),0.18mol•L-1 CH3COONa的pH约为9.
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
c>b>d>a(填编号),0.18mol•L-1 CH3COONa的pH约为9.
4.自然环境与人们的生活息息相关.下列有关环境的说法不正确的是( )
| A. | 氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应” | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 废旧电池的回收,其主要目的是为了保护环境 | |
| D. | 淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境 |