题目内容
与100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)基本相同的是( )
| A、200 mL 0.1 mol/L NH4Cl 溶液 |
| B、50 mL 0.2 mol/L NH4NO3溶液 |
| C、100 mL 0.2 mol/L NH4HSO4 |
| D、50 mL 0.2 mol/L氨水 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.
解答:
解:100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为:c(NH4+)=0.2mol/L,但是存在微弱的水解,c(NH4+)<0.2mol/L;
A、200 mL 0.1 mol/L NH4Cl 溶液,c(NH4+)=c(NH4Cl)=0.1mol?L-1,存在微弱的水解,所以c(NH4+)<0.1mol/L,故A错误;
B、50mL0.2mol/LNH4NO3溶液,c(NH4+)=0.2mol/L,但是存在微弱的水解,所以c(NH4+)<0.2mol/L,与100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)基本相同,故B正确;
C、100mL0.2mol/LNH4HSO4溶液,铵根离子会水解,所以c(NH4+)<0.2mol?L-1,但是同时氢离子会抑制水解,所以c(NH4+)比100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)略大点,故C错误;
D、50mL0.2 mol/L氨水是弱电解质,电离出的c(NH4+)远小于0.2mol/L,故D错误.
故选B.
A、200 mL 0.1 mol/L NH4Cl 溶液,c(NH4+)=c(NH4Cl)=0.1mol?L-1,存在微弱的水解,所以c(NH4+)<0.1mol/L,故A错误;
B、50mL0.2mol/LNH4NO3溶液,c(NH4+)=0.2mol/L,但是存在微弱的水解,所以c(NH4+)<0.2mol/L,与100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)基本相同,故B正确;
C、100mL0.2mol/LNH4HSO4溶液,铵根离子会水解,所以c(NH4+)<0.2mol?L-1,但是同时氢离子会抑制水解,所以c(NH4+)比100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)略大点,故C错误;
D、50mL0.2 mol/L氨水是弱电解质,电离出的c(NH4+)远小于0.2mol/L,故D错误.
故选B.
点评:本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,题目难度不大,注重了基础知识的考查,注意溶液中所含微粒的物质的量浓度与所取溶液的体积大小无关.

练习册系列答案
相关题目
下列几种情况对中和滴定结果无影响的是( )
| A、盛待测液的锥形瓶里留有蒸馏水 |
| B、滴定管尖嘴部分在滴定前有气泡,滴定后气泡消失 |
| C、滴定管在滴定前未将刻度调在“0”,而调在“2.40” |
| D、滴定达终点时,俯视读数 |
硅单质及其化合物在材料领域中一直扮演着主要角色.下列叙述中,不正确的是( )
| A、硅酸钠是制备木材防火剂的原料 |
| B、硅单质可用来制造太阳能电池 |
| C、硅单质是制造玻璃的主要原料 |
| D、二氧化硅是制造光导纤维的材料 |
 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )| A、AgNO3溶液 |
| B、NaOH溶液 |
| C、水 |
| D、FeCl2溶液 |
 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )| A、属第17族元素 |
| B、属卤族元素 |
| C、属非金属元素 |
| D、有放射性 |
下列关于化学平衡常数的说法中,正确的是( )
| A、在任何条件下,化学平衡常数K都是一个定值 |
| B、当改变反应物的浓度时,化学平衡常数会发生改变 |
| C、化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 |
| D、化学平衡常数K与反应物的转化率是一一对应的 |
“冰,水为之,而寒于水”关于水凝结成冰的过程的描述正确的是( )
| A、△H>0,△S>0 |
| B、△H>0,△S<0 |
| C、△H<0,△S>0 |
| D、△H<0,△S<0 |
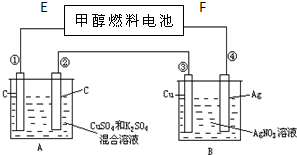 如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题: