题目内容
 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )| A、属第17族元素 |
| B、属卤族元素 |
| C、属非金属元素 |
| D、有放射性 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据原子核外电子排布规则,该原子结构示意图为 ,根据原子结构示意图知,该元素位于第七周期、第VIIA族,据此分析解答.
,根据原子结构示意图知,该元素位于第七周期、第VIIA族,据此分析解答.
 ,根据原子结构示意图知,该元素位于第七周期、第VIIA族,据此分析解答.
,根据原子结构示意图知,该元素位于第七周期、第VIIA族,据此分析解答.解答:
解:根据原子核外电子排布规则,该原子结构示意图为 ,主族元素,原子核外电子层数等于其周期数、最外层电子数等于其族序数,所以根据原子结构示意图知,该元素位于第七周期、第VIIA族,位于At元素下方,
,主族元素,原子核外电子层数等于其周期数、最外层电子数等于其族序数,所以根据原子结构示意图知,该元素位于第七周期、第VIIA族,位于At元素下方,
A.该元素属于第VIIA族元素,所以也属于第17族元素,故A正确;
B.该元素属于第VIIA族元素,所以也属于卤族元素,故B正确;
C.第七周期元素都是金属元素,所以该元素一定是金属元素,故C错误;
D.第七周期元素都有放射性,所以该元素一定是放射性元素,故D正确;
故选C.
 ,主族元素,原子核外电子层数等于其周期数、最外层电子数等于其族序数,所以根据原子结构示意图知,该元素位于第七周期、第VIIA族,位于At元素下方,
,主族元素,原子核外电子层数等于其周期数、最外层电子数等于其族序数,所以根据原子结构示意图知,该元素位于第七周期、第VIIA族,位于At元素下方,A.该元素属于第VIIA族元素,所以也属于第17族元素,故A正确;
B.该元素属于第VIIA族元素,所以也属于卤族元素,故B正确;
C.第七周期元素都是金属元素,所以该元素一定是金属元素,故C错误;
D.第七周期元素都有放射性,所以该元素一定是放射性元素,故D正确;
故选C.
点评:本题考查元素性质及元素位置的判断,侧重考查学生知识迁移能力,正确书写原子结构示意图是解本题关键,根据元素在周期表中的位置结合元素周期律解答,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
利用下列装置,能顺利完成对应实验或操作的是( )
A、 石油的分馏 |
B、 制氢氧化亚铁 |
C、 检查装置气密性 |
D、 实验室制取氨 |
有些物质的制备从化学性质的“强制弱”看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是( )
A、NaBr(s)+H3PO4(浓)
| ||
B、6CaO(l)+2Al(l)
| ||
| C、CaCO3(s)+2HCl(aq)→CaCl2(aq)+H2O (l)+CO2(g) | ||
| D、KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq)+S(s) |
与100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)基本相同的是( )
| A、200 mL 0.1 mol/L NH4Cl 溶液 |
| B、50 mL 0.2 mol/L NH4NO3溶液 |
| C、100 mL 0.2 mol/L NH4HSO4 |
| D、50 mL 0.2 mol/L氨水 |
若NA为阿伏加德罗常数的值.参阅表中数据,下列判断在标准状况下正确的是( )
| ℃ | NO2 | HF |
| 熔点 | -11.2 | -83.6 |
| 沸点 | 21.0 | 19.52 |
| A、20.0 gHF中含σ键数目为1.0NA |
| B、将22.4LNH3溶于1L水中,溶液含有OH-数目为0.1NA |
| C、6.72 LNO2与水反应后,转移的电子数为0.2NA |
| D、H2S和SO2各0.l mol反应后,体系中的S原子数目小于0.2NA |
A、B、C、D为短周期主族元素,且原子序数依次增大.已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最多的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A、原子半径:C>D>A>B |
| B、A的氧化物一定为酸性氧化物 |
| C、元素B和C只能形成一种化合物 |
| D、A、C、D的最高价氧化物对应的水化物均能两两相互反应 |
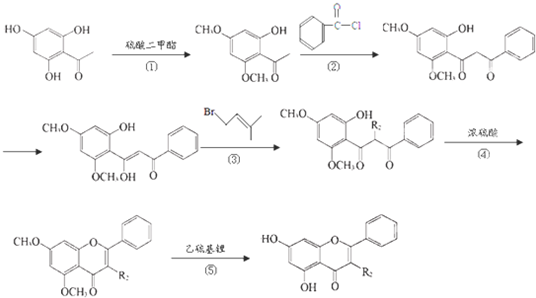
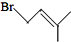 的同分异构体有
的同分异构体有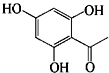 说法正确的是
说法正确的是